Для обратимого цикла Карно из выражений (3.20) и (3.21) следует, что
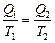 ,
,
или с учётом того, что 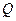 величина алгебраическая, получим
величина алгебраическая, получим
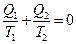 .
.
Величина 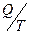 называется приведённым количеством теплоты. Следовательно, для цикла Карно сумма приведённых количеств теплоты равна нулю. Этот результат можно распространить на любые обратимые циклы, т.е.
называется приведённым количеством теплоты. Следовательно, для цикла Карно сумма приведённых количеств теплоты равна нулю. Этот результат можно распространить на любые обратимые циклы, т.е.
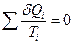 , или
, или 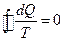 . (3.22)
. (3.22)
Полученный результат означает, что 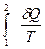 не зависит от пути интегрирования (последовательности промежуточных состояний), то есть величина
не зависит от пути интегрирования (последовательности промежуточных состояний), то есть величина 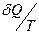 является полным дифференциалом
является полным дифференциалом
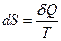 . (3.23)
. (3.23)
Функция состояния S, дифференциалом которой является 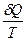 , называется энтропией:
, называется энтропией: 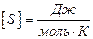 .
.
Изменение энтропии при переходе системы из состояния 1 в состояние 2 равно
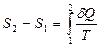 . (3.24)
. (3.24)
В частности, для идеального газа
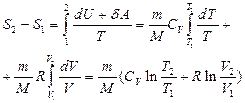 . (3.25)
. (3.25)
В изолированной системе, предоставленной самой себе, процессы происходят в направлении увеличения энтропии. Следовательно, состояние равновесия характеризуется максима- льной энтропией. Обратимыеадиабатические процессы, для которых 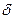 Q =0, характеризуются постоянной энтропией, S = const.
Q =0, характеризуются постоянной энтропией, S = const.
Все реальные процессы необратимы. Энтропия в них растет. Поэтому для всех возможных процессов в изолированной системе (включая и обратимый) получаем
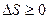 , (3.26)
, (3.26)
то есть энтропия либо растёт, либо остаётся неизменной. Этот результат является ещё одним выражением второго начала термодинамики: в любых процессах, протекающих в изолированных системах, энтропия не убывает. Второй закон термодинамики определяет направленность тепловых процессов в изолированных системах: они всегда протекают в сторону увеличения энтропии.Если система не изолирована, то её энтропия может как возрастать, так и убывать в зависимости от знака 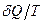 .
.
Как было установлено Больцманом, энтропия связана с термодинамической вероятностью системы W следующей формулой
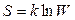 , (3.27)
, (3.27)
где k – постоянная Больцмана.
Термодинамическая вероятность W - это число способов, которыми может быть реализовано данное состояние макро- скопической системы. Чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия. В состоянии равновесия, т.е. наиболее вероятном состоянии, число микросостояний максимально, при этом максимальна и энтропия. Следовательно, энтропия является мерой неупорядо- ченности системы.
 2015-05-14
2015-05-14 720
720








