ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1. Указать химический характер предложенных оксидов:
1) Cs2O; 2) BeO; 3) SO2; 4) ВаО.
Ответ: 1) Cs2O – основной оксид; 2) BeO – амфотерный оксид;
3) SiO2 – кислотный оксид; 4) ВаО – основной оксид.
2. Указать тип предложенных солей:
1) FeOHCl; 2) Al2(SO4)3; 3) NaHS; 4) Na2SiO3.
Ответ: 1) FeOHCl – основная соль; 2) Al2(SO4)3 – средняя соль;
3) NaHS – кислая соль; 4) Na2SiO3 –средняя соль.
3. Написать формулы кислот, которым соответствуют следующие ангидриды:
1) N2O5; 2) SnO2; 3) SO3; 4) As2O3.
Ответ: Элемент, образующий ангидрид, проявляет одинаковую степень окисления и в ангидриде, и в соответствующей ему кислоте:
1) N+52O5 – HN+5O3; 2) Sn+4O2 – H2Sn+4O3;
3) S+6O3 – H2S+6O4; 4) As+32O3 – H3As+3O3.
2. ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТОВ
УРОВЕНЬ А
1.Определить число моль эквивалентов металла, содержащегося в 40 г Са.
Ответ:
n эк(Ме) = 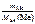 , моль;
, моль;
М эк(Ме) =  , г/моль,
, г/моль,
где В – валентность металла.
М Са = 40 г/моль, В Са = 2 (см. Периодическую систему элементов);
М эк(Са) = 40/2 = 20 г/моль. Тогда в 40 г Са содержится n эк(Ме) =
= 40: 20 = 2 моль эквивалентов металла.
2.Определить молярную массу эквивалента оксида хрома (III).
Ответ:
М эк(Сr2O3) = М эк(Сr) + M эк(О);
М эк(Сr) = 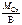 ,
,
где В – валентность хрома, равная 3.
М эк(О) = 8 г/моль;
М эк(Сr2O3) = 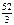 + 8 = 17,33 г/моль.
+ 8 = 17,33 г/моль.
3.Определить молярную массу эквивалента карбоната натрия.
Ответ:
М эк(Na2CO3) = 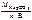 ,
,
где n – число атомов натрия в молекуле соли;
В – валентность натрия, равная 1.
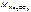 = 2·23+12+3·16 = 106 г/моль.
= 2·23+12+3·16 = 106 г/моль.
М эк(Na2CO3) = 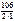 =53 г/моль.
=53 г/моль.
 2015-05-10
2015-05-10 477
477







