ЛАБОРАТОРНАЯ РАБОТА №11
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ УДЕЛЬНЫХ
ТЕПЛОЕМКОСТЕЙ ГАЗОВ.
Цель работы
Определить отношения удельных теплоемкостей газов по способу Клемана и Дезорьа.
Теория работы
Термодинамическая система — совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией, как между собой, так и с другими телами. Состояние системы задается термодинамическими параметрами — совокупностью физических величин, характеризующих свойства термодинамической системы. Обычно в качестве параметров состояния выбирают температуру, давление и удельный объем. Связь между параметрами состояния называется уравнением состояния, которое в общем виде дается выражением
f (Р,V,T) = 0.
В молекулярно-кинетической теории пользуются моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежительно мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным, а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу.
Уравнение состояния идеального газа — уравнение Менделеева-Клапейрона
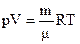 (1)
(1)
описывает состояние идеального газа объемом V, предоставленным массе m газа с молярной массой m, при абсолютной температуре Т газа и давлении Р (R = 8·31 Дж / (моль·К) — универсальная газовая постоянная).
Связь между давлением газа и, его объемом и энергией устанавливает уравнение кинетической теории газов. Для идеального газа, т.е. газа, потенциальной энергией взаимодействия между молекулами которого можно пренебречь; это уравнение выглядит следующим образом:
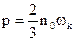 , где n0 – концентрация молекул; wk – средняя кинетическая энергия поступательного движения одной молекулы газа.
, где n0 – концентрация молекул; wk – средняя кинетическая энергия поступательного движения одной молекулы газа.
Т.к. 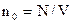 , то
, то 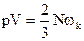 . Считая Nwk = Eпост , где Епост – суммарная кинетическая энергия поступательного движения одной молекулы:
. Считая Nwk = Eпост , где Епост – суммарная кинетическая энергия поступательного движения одной молекулы:
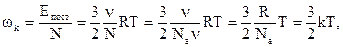
где k=R/Na=1,38*10-23 Дж/к – постоянная Больцмана (Na – число Авогардо). При поступательном движении молекул существует три независимых направлениях их движения. Все направления движения равновероятны. Разложив скорости молекул на составляющие вдоль осей, что средняя кинетическая энергия движения одной молекулы вдоль каждой оси:
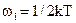 (2)
(2)
Обычно w1 называют средней энергией молекулы, приходящейся на одну степень свободы. Введем понятие числа степеней свободы — это число независимых координат, полностью определяющих положение молекулы в пространстве. Молекулы одноатомного газа можно рассматривают как материальные точки, т.к. масса такой молекулы сосредоточена в ядре, размеры которой очень малы. Поэтому молекулы одноатомного газа может иметь лишь три степени свободы поступательного движения (i = 3). Молекулы, состоящие из двух, трех и большего числа атомов, не могут быть уподоблены материальным точкам. Поэтому молекула двухатомного газа, помимо трех степеней свободы поступательного движения, имеет еще две степени свободы вращательного движения вокруг осей О1 – О1 и О2 – О2 (рис.1.) (i = 5). Молекулы трех- и многоатомных газов подобно твердому телу обладают тремя степенями свободы поступательного движения и тремя степенями свободы вращательного движения (i = 6) (рис.2.).
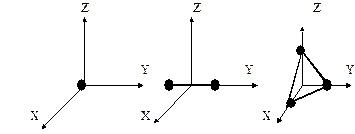
а б в
Рис. 1
При увеличении числа степеней свободы энергия, приходящая на каждую степень свободы, остается равной w1, а средняя кинетическая энергия одной молекулы увеличивается. При этом соблюдается закон равномерного распределения энергии по степеням свободы. В соответствии с этим законом, учитывая поступательное и вращательное движение молекул, формулу средней кинетической энергии молекул перепишем в следующем виде:
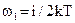 (3)
(3)
Внутренней энергией системы U называется сумма потенциальных энергий взаимодействия и кинетических энергий микрочастиц этой системы. Для идеального газа:
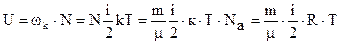
где µ — молярная масса, ν — количество вещества.
При изменении температуры изменение внутренней энергии определенной массы идеального газа:
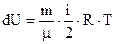 (4)
(4)
Внутренняя энергия системы может изменяться в результате совершения над системой работы или в процессе теплообмена: 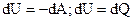 , где dA – работа внешних сил над системой; dQ – количество теплоты, сообщаемое системе извне. Если оба процесса протекают одновременно, то:
, где dA – работа внешних сил над системой; dQ – количество теплоты, сообщаемое системе извне. Если оба процесса протекают одновременно, то:
dU = dQ - dA, (5)
где dU — бесконечно малое изменение внутренней энергии системы; dА — элементарная работа; dQ — бесконечно малое количество теплоты.
Данная форма является наиболее общей записью закона превращения энергии в термодинамике – это первое начало термодинамики. Количество энергии, сообщенной системе в процессе теплообмена, идет на изменение ее внутренней энергии и на совершение системой работы против внешних сил:
dQ = dU + dA, (6)
где dA можно представить:
dА = р·dV (7)
Работа, как и количество теплоты, есть функция не только начало и конца процесса 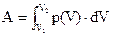 , но зависит и от промежуточных точек, через которые идет процесс. Такие функции называются функциями процесса. Следовательно dA не является полным дифференциалом. Важен случай, когда в результате некоторого процесса газ или пар возвращается в первоначальное состояние, т.е. dU=0, а это означает, что:
, но зависит и от промежуточных точек, через которые идет процесс. Такие функции называются функциями процесса. Следовательно dA не является полным дифференциалом. Важен случай, когда в результате некоторого процесса газ или пар возвращается в первоначальное состояние, т.е. dU=0, а это означает, что:
dA=dQ (8)
Работа системы равна подведенному извне количеству теплоты. Тогда первое начало термодинамики можно сформулировать так: нельзя построить периодически действующий двигатель, который совершал бы работу, большую, чем количество сообщенной ему извне энергии. Теплоемкость тела характеризуется количеством теплоты, необходимым для нагревания этого тела на один градус:
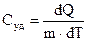 (9)
(9)
Единица удельной теплоемкости — Дж/(кг·К).
Молярная теплоемкость — величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1К:
Сμ=Суд·μ (10)
По формулам (6), (7), (4):
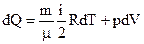 (11)
(11)
Вычислим удельную теплопроводимость:
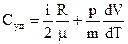 (12)
(12)
и молекулярную теплопроводимость:
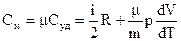 (13)
(13)
Среди процессов, которые могут происходить в газах, наиболее часто приходиться иметь дело с изопроцессами. Так называются процессы в газах, при которых один из трех параметров (p, V или T) сохраняется постоянным. Выделяют следующие изопроцессы:
1. Изохорический процесс – процесс, когда система переходит из одного состояния в другое при неизменном объеме (V = const). Уравнение процесса: p/T = const.
2. Изобарический процесс – система переходит из одного состояния в другое при постоянном давлении (р = const). Уравнение процесса: V/T = const.
3. Изотермический процесс – процесс, при котором постоянной остается температура (Т = const). Уравнение процесса: pV = const.
4. Адиабатический процесс – процесс, при котором система переходит из одного состояния в другое без обмена энергией с внешними телами. Практически адиабатический процесс возникает при быстром расширении или сжатии газа, т.е. теплообмен между газом и внешней средой не успевает произойти. Адиабатический процесс происходит при полной термодинамической изолированности системы, т.е. процесс протекает за счет изменения внутренней энергии системы (рис.3.)
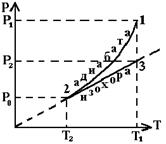
Рис. 3
Таким образом, у газов различают теплоемкость при постоянном объеме СV и теплоемкость при постоянном давлении Ср. При V = const работа внешних сил равна нулю. Отсюда молярная теплоемкость газа при постоянном объеме СVМ (см. 3):
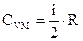 , т.к. dV = 0.
, т.к. dV = 0.
Аналогично вычислим СрМ. Для изобарического процесса 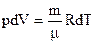 .
.
Следовательно, с учетом (13)
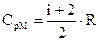 (15)
(15)
Сопоставляя (4) и (15), получим уравнение Майлера:
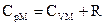 (16)
(16)
Для удельных теплопроводимости газов, т.к. Суд=СМ/m, то:
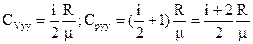 (17)
(17)
Отношение удельных проводимостей называется коэффициентом Пуассона. Используя (17), получим:
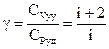 (18)
(18)
Это отношение зависит от числа степеней свободы молекул, из которых состоит газ. Кроме того g входит в уравнение, описывающее адиабатический процесс – уравнение Пуассона:
РVg=const (19)
 2015-05-14
2015-05-14 243
243







