S º(298 K) 66,1 5,7 64,9 197,5
Дж/моль К ·
Δ rH º(298 K) = –110,5 – (–219,3) = 108,8 кДж,
Δ rS º(298 K) = 197,5 + 64,9 – 5,7 – 66,1 = 190,6 Дж/К.
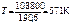 .
.
Ответ: процесс возможен при нагревании с Т =571 К.
1. Вычислить массовую долю оксида цинка в смеси с цинком, если при взаимодействии 7,27 г смеси с водным раствором щелочи выделилось 1,12 л водорода (н.у.).Поскольку водород выделяется только при взаимодействии цинка с водным раствором щелочи, то массу цинка определяем из уравнения реакции:
Zn + 2H2О + 2NaOH = Na2[Zn(OH)4] + H2
Zn – 2e = Zn2+ 1
2H+ + e = H 2
Zn + 2H+ = Zn2+ + 2H
Составляем пропорцию:
65,4 г Zn 22,4 л Н2
mZn 1,12 л Н2,
где МZn = 65,4 г/моль.
m Zn = 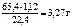 .
.
m ZnО = m смеси – m Zn = 7,27 – 3,27 = 4 г.
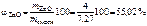 .
.
Ответ: 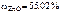 .
.
Рассчитать константу равновесия в реакции цементации
CuSO4(р-р) + Fe(к) < = > FeSO4(р-р) + Cu(к),
 2015-05-10
2015-05-10 623
623








