Степень окисления – это условный электрический заряд данного атома, вызванный смещением валентных электронов к более электроотрицательному атому. Валентными электронами называются электроны, участвующие в образовании химической связи (их число равно номеру группы, в которой стоит элемент). Ст. окис. может иметь отрицательное, положительное и нулевое значение, которое обычно выражают арабскими цифрами со знаком (+) или (-) и ставят над символом элемента.
Например: 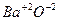 ;
; 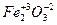 ;
; 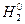 ;
; 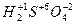
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью – положительные. Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Например:
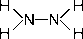 N2 H4 (гидразин)
N2 H4 (гидразин)
степень окисления азота – «-2»; валентность азота – III.
Валентность – это число связей, которые может образовать атом в соединениях.
Для вычисления степени окисления элемента учитывают следующие положения:
1. Степени окисления атомов в простых веществах равны нулю (Na0; H20).
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю ([ S+6O3-2 ] 0), а в сложном ионе эта сумма равна заряду иона ([S+6O4-2]2-).
3. Постоянную степень окисления имеют атомы:
- щелочных металлов (+1),
- щелочноземельных металлов (+2),
- водорода (+1) (кроме гидридов активных металлов: 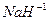 ,
, 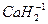 и др.),
и др.),
- кислорода (-2) (кроме фторида кислорода O+2F2-1 и пероксидов, содержащих группу –O–O–, Н2О2-1).
4. Высшая положительная степень окисления элемента равна номеру группы ПС.
5. Низшая степень окисления вычисляется по формуле –(8 – N), где N – номер группы.
‼ Отрицательная степень окисления проявляется у неметаллов, начиная с IV группы.
ОКСИДЫ
Оксиды - это сложные хим. соединения, состоящие из двух элементов, один из которых кислород.
 2015-05-18
2015-05-18 207
207







