1. Взаимодействие с основаниями (реакция нейтрализации):
2HNO3 + Ca(OH)2 ® Ca(NO3)2 + 2H2O
2. Взаимодействие с основными оксидами:
2HNO3 + CuO 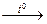 Cu(NO3)2 + H2O
Cu(NO3)2 + H2O
3. Взаимодействие с металлами:
6HCl + 2Al ® 2AlCl3 + 3H2
(металлы, стоящие в ряду напряжений до водорода, кислоты-неокислители).
4. Взаимодействие с солями (реакции обмена), при которых выделяется газ или образуется осадок:
H2SO4 + BaCl2 ® BaSO4¯ +2HCl
2HCl + K2CO3 ® 2KCl + H2O + CO2
5. При нагревании кислоты разлагаются на кислотный оксид и воду:
H2SO4 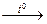 SO3 + H2O
SO3 + H2O
6. В водных растворах кислоты диссоциируют на катионы водорода и анионы кислотных остатков:
H2SO4 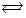 H+ + HSO4– (I ступень)
H+ + HSO4– (I ступень)
HSO4– 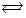 H+ + SO4 2– (II ступень)
H+ + SO4 2– (II ступень)
Ионы водорода придают кислотам кислый вкус и изменяют окраску индикаторов. Никаких других катионов, кроме ионов водорода, кислоты не образуют.
7. Действие на индикаторы:
лакмус – красный,
метилоранж – розовый
СОЛИ
Соли - сложные вещества, которые состоят из атомов металла и кислотных остатков. Это наиболее многочисленный класс неорганических соединений.
 2015-05-18
2015-05-18 254
254








