Одним из наиболее важных свойств нитрогруппы является ее способность восстанавливаться с образованием ароматических аминов.
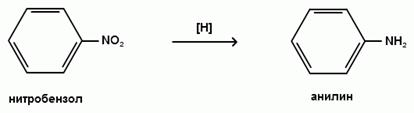
Восстановление нитробензола в анилин было проведено впервые Н.Н. Зининым в 1842 году с помощью сульфида аммония.
Открытие этой реакции сыграло исключительную роль в развитии химической технологии, особенно в области синтеза красителей и медикаментов.
«Если бы Н.Н. Зинин не научил нас ничему более, кроме превращения нитробензола в анилин, и тогда бы имя его осталось записанным золотыми буквами в истории химии» (Гофман).
Восстановление нитросоединений сильно зависит от рН-среды и применяемого восстановителя. В результате образуются различные промежуточные соединения, которые нашли широкое применение в органическом синтезе.
При восстановлении нитробензола в кислой среде (рН < 6) железными опилками, оловом или цинком через невыделяемые промежуточные соединения (нитрозобензол и N-фенилгидроксиламин) получают анилин:
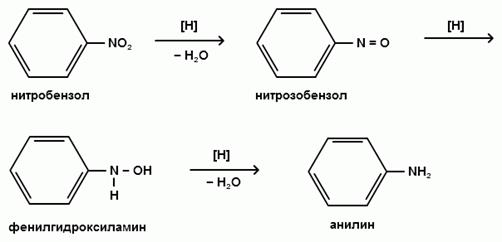
При восстановлении нитробензола в нейтральной среде (рН =7) получают фенилгидроксиламин.
При восстановлении цинком в щелочной среде (рН > 8) промежуточными продуктами являются азоксибензол, азобензол, гидразобензол. Эти соединения образуются в результате конденсации возникающих на промежуточной стадии нитрозобензола и N-фенилгидроксиламина. В кислой среде подобная реакция не происходит.
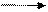




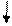
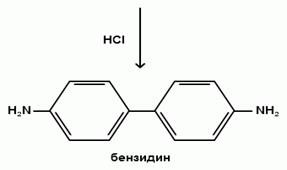
В присутствии кислот происходит изомерзация гидразобензола в бензидин.
Такой переход известен под названием бензидиновой перегруппировки (Зинин Н.Н., 1845 г.)
2. Реакции электрофильного замещения
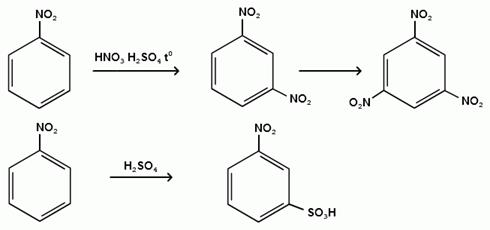
Реакции электрофильного замещения протекают труднее, чем у бензола, что обусловлено сильным электроноакцепторным действием нитрогруппы. Замещение происходит в мета-положение, так как нитрогруппа – ориентант П рода (SE2аром).
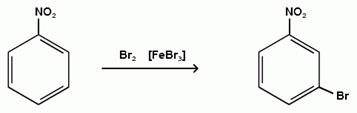
Поэтому реакции электрофильного замещения осуществляются только с сильными реагентами (нитрование, сульфирование, галогенирование) в более жестких условиях:
3. Реакции нуклеофильного замещения
В реакциях нуклеофильного замещения (SN2аром) нитрогруппа направляет нуклеофил в орто- и пара-положения.
Например, сплавление нитробензола с КОН при 1000С приводит к получению орто- и пара-нитрофенолов:
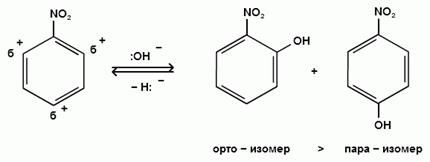
Более предпочтительной является атака в орто-положение, поскольку отрицательный индуктивный эффект нитрогруппы, действуя на малом расстоянии, создает большую нехватку электронов в орто-, чем в пара-положении.
 2015-05-20
2015-05-20 6501
6501
