ЛАБОРАТОРНАЯ РАБОТА № 179
ПОЛИТРОПИЧЕСКИЙ ПРОЦЕСС
Ознакомьтесь с теорией в конспекте и учебнике (Савельев, т. 1, § 82, 97). Запустите программу. Выберите «Термодинамика и молекулярная физика», «Адиабатический процесс». Нажмите кнопку с изображением страницы во внутреннем окне. Прочитайте теорию и запишите необходимое в свой конспект лабораторной работы. Закройте окно теории, нажав кнопку с крестом в правом верхнем углу внутреннего окна.
ЦЕЛЬ РАБОТЫ:
* Знакомство с компьютерной моделью, описывающей адиабатический процесс в идеальном газе.
* Экспериментальное подтверждение закономерностей адиабатического процесса.
* Экспериментальное определение показателя адиабаты, количества степеней свободы и структуры молекул газа в данной модели.
* Ознакомление с основами анализа и моделирования термодинамических процессов в идеальных газах.
* Определение молярной теплоемкости в политропических процессах идеального газа.
* Определение показателя адиабаты и работы газа в политропическом процессе.
* КРАТКАЯ ТЕОРИЯ:
* СОСТОЯНИЕ системы имеет фиксированные значения макроскопических параметров, описывающих систему в целом. Параметры, характеризующие систему в целом, называются ПАРАМЕТРАМИ СОСТОЯНИЯ. Примерами являются температура, давление, объем и т. д.
* РАВНОВЕСНЫМ называется такое состояние системы, при котором все параметры системы имеют определенные значения, остающееся неизменными сколь угодно долго при неизменных внешних условиях.
* ОБРАТИМЫМ называется процесс, при реализации которого в обратном направлении система проходит через те же состояния, что и при прямом ходе, но в обратной последовательности. Равновесные процессы всегда обратимы.
* КРУГОВЫМ процессом (ЦИКЛОМ) называется процесс, при котором система после ряда изменений возвращается в исходное состояние.
* УРАВНЕНИЕ СОСТОЯНИЯ идеального газа (уравнение Менделеева–Клапейрона)
* 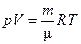 .
.
* ТЕПЛОЕМКОСТЬ тела численно равна отношению количества тепла ∂ Q, сообщенного телу, к изменению температуры тела dT, которое при этом произошло:
* С ТЕЛА = 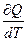 .
.
* УДЕЛЬНОЙ теплоемкостью вещества называется отношение теплоемкости к массе тела.
* Если тело не меняет свой объем, то оно не совершает работы, поэтому при постоянном объеме тела переданное телу тепло ∂ Q идет на изменение его внутренней энергии dU.
* ТЕПЛОЕМКОСТЬ ПРИ ПОСТОЯННОМ ОБЪЕМЕ:
* С V = 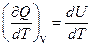 .
.
* ТЕПЛОЕМКОСТЬ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ идеального газа, молекулы которого имеют i степеней свободы
* C P = 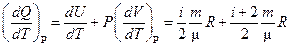 (1).
(1).
* ОТНОШЕНИЕ 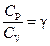 является константой (в определенном диапазоне температур) для данного газа. Эта константа называется показателем адиабаты.
является константой (в определенном диапазоне температур) для данного газа. Эта константа называется показателем адиабаты.
* Формула 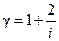 (2) устанавливает связь отношения теплоемкостей g с числом степеней свободы молекулы газа i.
(2) устанавливает связь отношения теплоемкостей g с числом степеней свободы молекулы газа i.
* ЧИСЛО (количество) СТЕПЕНЕЙ СВОБОДЫ есть минимальное количество независимых координат, необходимых для однозначного описания положения молекулы в пространстве ИЛИ минимальное количество независимых движений, суперпозиция которых дает любое движение молекулы.
* ПОСТУПАТЕЛЬНОЕ ДВИЖЕНИЕ всегда дает 3 степени свободы.
* ВРАЩАТЕЛЬНОЕ ДВИЖЕНИЕ дает 2 степени свободы для линейной молекулы и 3 степени свободы, если атомы в молекуле не расположены на одной линии.
* КОЛЕБАТЕЛЬНОЕ ДВИЖЕНИЕ дает 2 n КОЛ степеней свободы, где n КОЛ – количество независимых колебаний атомов в молекуле (у двухатомной молекулы n КОЛ = 1).
* АДИАБАТИЧЕСКИМ называется процесс, происходящий без теплообмена с внешней средой (∂ Q = 0). Уравнение адиабаты:
* PV g = const (3).
* Принято также выделять ИЗОТЕРМИЧЕСКИЙ, ИЗОБАРИЧЕСКИЙ и ИЗОХОРИЧЕСКИЙ процессы.
* ПОЛИТРОПНЫМ называется процесс, в котором молярная теплоемкость С остается постоянной. Уравнение политропического процесса имеет вид:
* рV n = const, (1)
* где n = 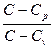 . (2)
. (2)
* МОЛЯРНОЙ ТЕПЛОЕМКОСТЬЮ называется физическая величина С, численно равная теплоте 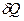 , которую нужно сообщить одному молю вещества для изменения его температуры на 1 К в рассматриваемом термодинамическом процессе:
, которую нужно сообщить одному молю вещества для изменения его температуры на 1 К в рассматриваемом термодинамическом процессе:
* С = 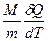 , (3)
, (3)
* где M – молярная масса, m – масса газа.
* Выражение (3) теперь можно записать в форме
* 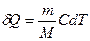 . (4)
. (4)
* или в интегральной форме 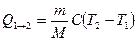 .
.
* Таким образом, если количество тепла, полученное в некотором термодинамическом процессе 1®2 при m = const, прямо пропорционально разности температур 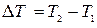 , то теплоемкость газа постоянна и процесс является политропическим.
, то теплоемкость газа постоянна и процесс является политропическим.
* 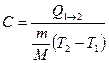 .
.
* ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ для любого равновесного процесса изменения состояния идеального газа имеет вид
* 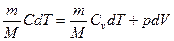 . (5)
. (5)
* Тогда из уравнения (5) имеем: C = Cv + 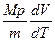 . (6)
. (6)
* Связь между объемом газа и его температурой в политропном процессе можно найти из выражения (1) и уравнения Клапейрона–Менделеева
* 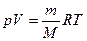 :
:
*
* 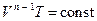 .
.
* Дифференцируя последнее выражение, получим:
*
* 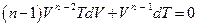 ,
,
*
* 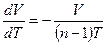 .
.
*
* Тогда уравнение (6) примет вид:
* 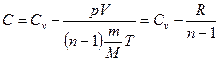 .
.
* Учитывая, что 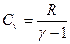 , где
, где 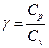 – показатель адиабаты, получим:
– показатель адиабаты, получим:
* 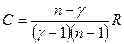 ,
,
* или 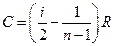 . (7)
. (7)
* Таким образом, если термодинамический процесс идеального газа действительно является политропным, то есть молярная теплоемкость в ходе процесса не изменяется, то ее величина рассчитывается по формуле (7).
* В настоящей работе используется модель одноатомного газа (i = 3), поэтому в политропных процессах при n = -1 согласно выражению (7) молярная теплоемкость С должна быть равна 16,6 Дж/моль×К, а при n = -2 C = 15,2 Дж/моль×К.
* Частными случаями политропного процесса являются:
* изотермический: n = 1, C = ± ¥;
* изобарический: n = 0, C = C p;
* изохорический: n = ±¥, С = С v;
* адиабатический: n = g, где g = 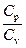 , С = 0.
, С = 0.
МЕТОДИКА И ПОРЯДОК ИЗМЕРЕНИЙ
Внимательно рассмотрите картинку на рисунке, найдите рисунок элемента, в котором реализуется адиабатический процесс, обратите внимание на его теплоизоляцию. Найдите математическую формулировку условия теплоизоляции. Ознакомьтесь с графиками в правой части изображения.
Зарисуйте необходимое в свой конспект лабораторной работы.
 2015-05-10
2015-05-10 939
939







