1.1. Природа ЭДС и электродного потенциала.
ЭДС
ЭЛЕКТРОДВИЖУЩАЯ СИЛА — величина, характеризующая источник энергии неэлектростатической природы в электрической цепи, необходимый для поддержания в ней электрического тока. Потенциальные силы электростатического (или стационарного) поля не могут поддерживать постоянный ток в цепи. Для поддержания в цепи непрерывного тока необходим источник тока или генератор электрического тока, обеспечивающий действие сторонних сил. Сторонние силы имеют неэлектростатическое происхождение и действуют внутри источников тока (генераторов, гальванических элементов, аккумуляторов и т. д.), создавая разность потенциалов между концами остальной части цепи и приводя в движение заряженные частицы внутри источников тока.
Так как при перемещении электрического заряда по замкнутой цепи работа, совершаемая электростатическими силами, равна нулю, то заряд перемещается лишь под действием сторонних сил. Поэтому электродвижущая сила источника тока будет численно равна работе сторонних сил А в источниках постоянного или переменного тока по перемещению единичного положительного заряда Qвдоль замкнутой цепи. ЭДС, действующая в цепи, определяется как циркуляция вектора напряженности сторонних сил.
Полная ЭДС в цепи постоянного тока (максимальное из этих напряжений,
существующее при разомкнутой цепи), равна разности потенциалов на концах разомкнутой цепи и показывает ЭДС источника.
Измеряется ЭДС, как и напряжение, в вольтах.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ – это разность электростатических потенциалов между электродом и находящимся с ним в контакте электролитом.
Возникновение электродного потенциала обусловлено пространственным разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя. На границе между металлическим электродом и раствором электролита пространственное разделение зарядов связано со следующими явлениями:
1)Переносом ионов из металла в раствор в ходе установления электрохимического равновесия.
2) Кулоновской адсорбцией ионов из раствора на поверхность металла.
3) Смещением электронного газа за пределы положительно заряженного ионного остова кристаллической решетки.
4) Специфической (некулоновской) адсорбцией ионов или полярных молекул растворителя на электроде и др.
Последние два явления приводят к тому, что электродный потенциал не равен нулю даже при условиях, когда заряд поверхности металла равен нулю.
Абсолютную величину электродного потенциала отдельного электрода определить невозможно, поэтому измеряют всегда разность потенциалов исследуемого электрода и некоторого стандартного электрода сравнения. Электродный потенциал равен ЭДС электрохимической цепи,
составленной из исследуемого и стандартного электродов (диффузионный потенциал между разными электролитами, обусловленный различием скоростей движения ионов, при этом должен быть устранен).
1.2. Метод ЭДС при определении коэффициентов активности, чисел переноса, произведений растворимости и констант равновесия ионных реакций.
Для наиболее точного определения коэффициентов активности методом ЭДС используют химические цепи без переноса типа 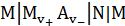 . ЭДС такой цепи можно представить в виде
. ЭДС такой цепи можно представить в виде
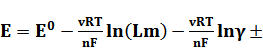 , (2)
, (2)
где L= 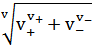 ; m — моляльность раствора соли
; m — моляльность раствора соли 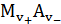 .
.
Уравнение (2) при заданном значении m содержит две неизвестные величины: Е° и 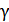 ±.
±.
Для их определения строят график зависимости
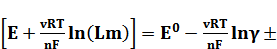 от
от 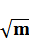 (3)
(3)
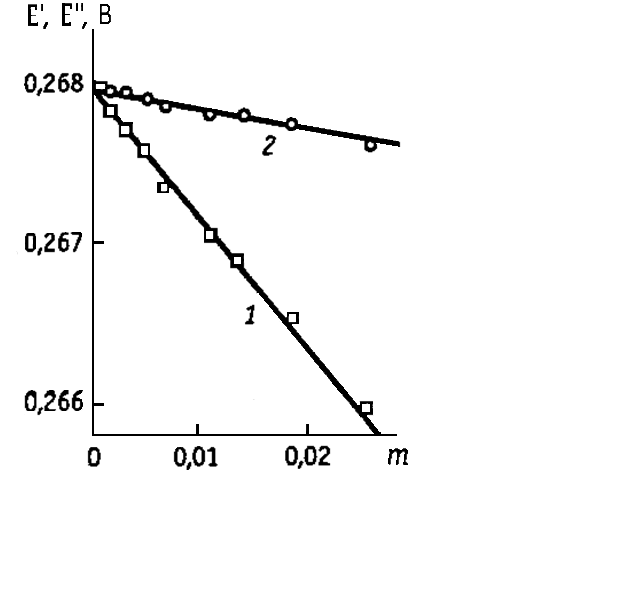
Рис. 1. Уточненный графический метод определения стандартного потенциала хлорсеребряного электрода по изменениям ЭДС:
1- с учетом 3-го приближения теории Дебая-Хюккеля; 2 – с одновременным учетом 2-го и 3-го приближений теории Дебая-Хюккеля.
Если измерения ЭДС выполнены с очень высокой точностью, то имеет смысл проводить экстраполяцию зависимостей
Е'= 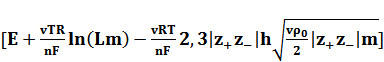 от m (4)
от m (4)
Или
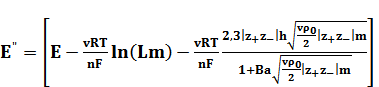 от m. (5)
от m. (5)
Эти зависимости линейны в широком интервале концентраций, что является следствием 3-го приближения теории Дебая-Хюккеля. Но более существенно то, что во всем интервале концентраций (до m = 0,03) величина Е" изменяется всего на 0,3 мВ. Таким образом, экстраполяцией в координатах Е” - m удается определить стандартный потенциал с точностью до 0,01 мВ. После нахождения Е0 средние коэффициенты активности для любой концентрации m можно рассчитать по уравнению (2).
Для определения чисел переноса используют разность потенциалов на концах концентрационной цепи с переносом типа 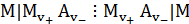 . Если известны коэффициенты активности (а следовательно, и значения а±) в исследуемых растворах, то число переноса аниона t- можно рассчитать по уравнению:
. Если известны коэффициенты активности (а следовательно, и значения а±) в исследуемых растворах, то число переноса аниона t- можно рассчитать по уравнению:
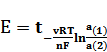 , (6)
, (6)
где 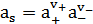 - активность соли;
- активность соли; 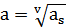 - средняя активность.
- средняя активность.
При этом конденсации двух растворов m1 и m2 не должны сильно отличаться друг от друга, тогда найденные числа переноса и t+ = 1-t- будут соответствовать средней концентрации 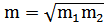 .
.
Знание стандартных потенциалов позволяет легко рассчитывать
произведение растворимости труднорастворимой соли или оксида. Для
потенциала электрода второго рода произведение растворимости соли 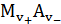 можно рассчитать по формуле:
можно рассчитать по формуле:
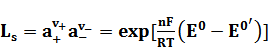 , (7)
, (7)
где Е° — стандартный потенциал электрода второго рода, на котором идет процесс 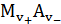 +
+ 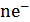 ↔
↔ 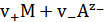 ; Е°'- стандартный потенциал электрода первого рода, отвечающий равновесию
; Е°'- стандартный потенциал электрода первого рода, отвечающий равновесию 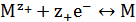 , где ион металла
, где ион металла 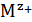 находится в той же степени окисления, что и в соли
находится в той же степени окисления, что и в соли 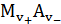 .
.
По значениям стандартных потенциалов можно оценить также собственную растворимость данного металла в чистом растворителе.
Рассмотрим метод ЭДС для определения констант равновесия ионных реакций на примере константы диссоциации слабой кислоты НА:
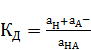 (8)
(8)
Для нахождения Кд собирают следующую электрохимическую цепь без переноса:
Pt, Н2 |НА, NaA, NaCl | AgCl, Ag | Pt (А)
m m' m”
где NaA — растворимая и полностью диссоциирующая натриевая соль кислоты НА.
На электродах в данной цепи протекают обратимые процессы
Н+ + е- ↔ 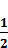 Н2 и AgCl + e- ↔ Ag + Сl-, (9)
Н2 и AgCl + e- ↔ Ag + Сl-, (9)
что в сумме дает химическую реакцию
AgCl +  Н2↔ Ag + НСl. (10)
Н2↔ Ag + НСl. (10)
Следовательно, ЭДС данной цепи равна
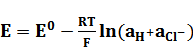 , (11)
, (11)
Где стандартная ЭДС 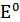 - та же самая, что и в цепи
- та же самая, что и в цепи
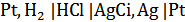 . (Б)
. (Б)
Исключая из уравнений (8) и (9) величину 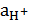 получаем:
получаем:
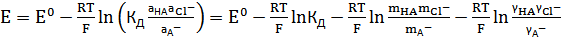 , (12)
, (12)
Где
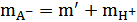 ;
; 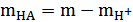 ;
; 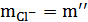 . (13)
. (13)
В первом приближении для слабой кислоты НА 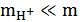 и
и 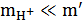 , а потому
, а потому 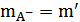 и
и 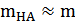 . Таким образом, из уравнения (12) следует:
. Таким образом, из уравнения (12) следует:
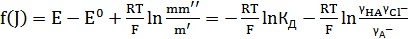 . (14)
. (14)
Экстраполяция функции f(J) к общей ионной силе раствора J=0 дает 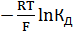 , так как при
, так как при 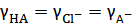 и последний член уравнения (14) обращается в нуль. В следующем приближении после нахождения
и последний член уравнения (14) обращается в нуль. В следующем приближении после нахождения 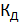 оценивают концентрацию ионов водорода, пользуясь приближенной формулой
оценивают концентрацию ионов водорода, пользуясь приближенной формулой
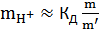 . (15)
. (15)
Затем рассчитывают величины 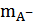 и
и 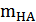 по соотношениям (13), подставляют их в уравнение (12) и повторяют определение
по соотношениям (13), подставляют их в уравнение (12) и повторяют определение 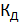 методом экстраполяции
методом экстраполяции
функции
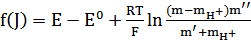 (16)
(16)
к J=0. Чем меньше константа диссоциации 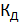 , тем меньшее число приближений приводит к окончательному результату.
, тем меньшее число приближений приводит к окончательному результату.
 2015-05-10
2015-05-10 2381
2381