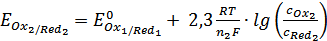 . (32)
. (32)
В этих выражениях 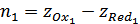 , а
, а 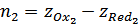 .
.
Поскольку 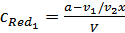 , а
, а 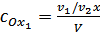 , то в соответствии с (30) потенциал платинового электрода
, то в соответствии с (30) потенциал платинового электрода
 , (
, (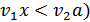 (33)
(33)
v – стехиометрический коэффициент, связанный с очевидным равенством: 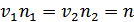 . (Здесь n – число электронов, соответствующее однократному протеканию реакции
. (Здесь n – число электронов, соответствующее однократному протеканию реакции 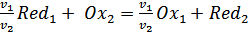 ).
).
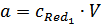 ;
; 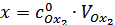 , где
, где 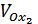 - объем приливаемого окислителя и
- объем приливаемого окислителя и 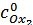 – исходная концентрация титранта.
– исходная концентрация титранта.
По мере приближения к точке эквивалентности, когда 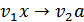 , потенциал резко облагораживается, и при достижении точки эквивалентности, определяемой соотношением:
, потенциал резко облагораживается, и при достижении точки эквивалентности, определяемой соотношением:
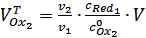 , (34)
, (34)
Должен бы принять бесконечно большое положительное значение. Это, однако, не имеет места. Дело в том, что при достаточно положительных потенциалах в растворе, в соответствии с реакцией (31) успевает генерироваться заметное количество формы 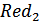 . В итоге потенциал Pt-электрода вблизи точки эквивалентности фактически является компромиссным, ибо он навязан электроду одновременно двумя редокс-системами:
. В итоге потенциал Pt-электрода вблизи точки эквивалентности фактически является компромиссным, ибо он навязан электроду одновременно двумя редокс-системами:
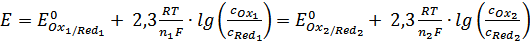 . (35)
. (35)
Из (26) следует, что
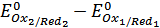 =
= 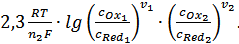 (36)
(36)
Для любого момента титрования справедливо условие: 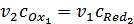 . Кроме
. Кроме
того, в точке эквивалентности, и только в ней, 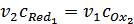 . Из этих двух условий следует, что в точке эквивалентности
. Из этих двух условий следует, что в точке эквивалентности 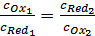 . Подставив это в выражение (27), получим
. Подставив это в выражение (27), получим
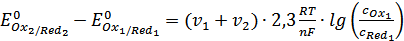 (37)
(37)
Сочетая (27) и (28), можно убедиться, что потенциал платинового индикаторного электрода в точке эквивалентности
 (
(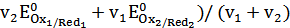 , (38)
, (38)
Т.е. имеет конечное значение.
После того, как точка эквивалентности пройдена, количество 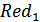 в перетитрованном растворе становится исчезающее малым, однако концентрации
в перетитрованном растворе становится исчезающее малым, однако концентрации 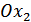 и
и 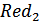 теперь имеют достаточно заметные значения. Потенциалопределяющей становится реакция (31), а потенциал Pt-электрода подчиняется уравнению (32). По мере дальнейшего увеличения
теперь имеют достаточно заметные значения. Потенциалопределяющей становится реакция (31), а потенциал Pt-электрода подчиняется уравнению (32). По мере дальнейшего увеличения 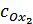 значение
значение 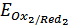 непрерывно облагораживается в соответствии с уравнением:
непрерывно облагораживается в соответствии с уравнением:
 , (
, (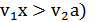 (39)
(39)
Как правило, потенциал индикаторного Pt-электрода измеряют относительно хлоридсеребряного электрода сравнения, составляя цепь:
⊖ Ag, AgCl|Cl-  KCl(нас)
KCl(нас)  Ox,Red|Pt, Ag ⊕. (Д)
Ox,Red|Pt, Ag ⊕. (Д)
Поскольку напряжение этой цепи 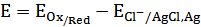 , то полная кривая потенциометрического Ox, Red – титрования (после подстановки выражений
, то полная кривая потенциометрического Ox, Red – титрования (после подстановки выражений
для а и х) имеет вид:
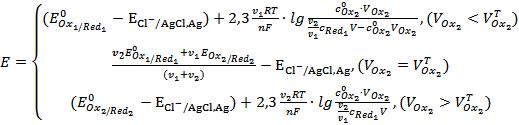 (40)
(40)
График зависимости (40) дан на рис. 2.
Рис. 2. Кривая потенциометрического Ox,Red титрования
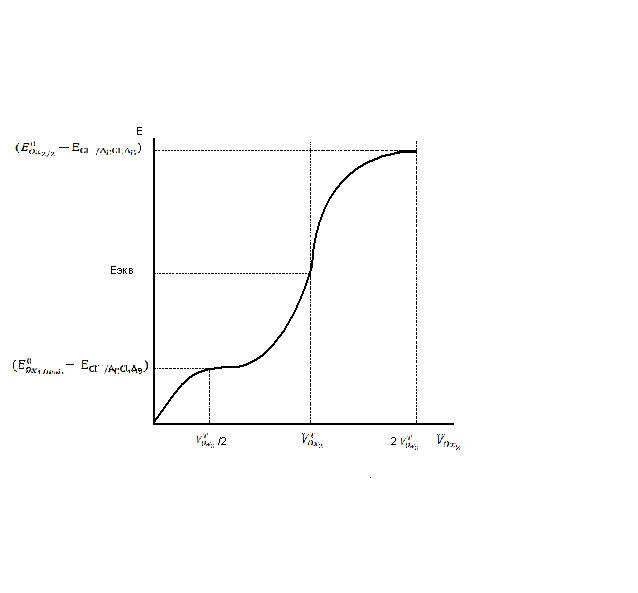
Найденные значения стандартных электродных потенциалов изученных Ox, Red-систем являются не слишком точными, т.к. получены без учета коэффициентов активности реагентов.
 2015-05-10
2015-05-10 775
775








