Целью нашей работы является ознакомление с конструкцией и реализация газового водородного электрода, определение с его помощью значение рН контрольного раствора. Для этого мы использовали: электролизер для получения газообразного электрода, водородный электрод в сборе; вольтметр с высоким выходным сопротивлением; хлоридсеребряный электрод сравнения.
Для начала мы собрали конструкцию: водородного электрода:
Рис. 3.Схема водородного электрода.
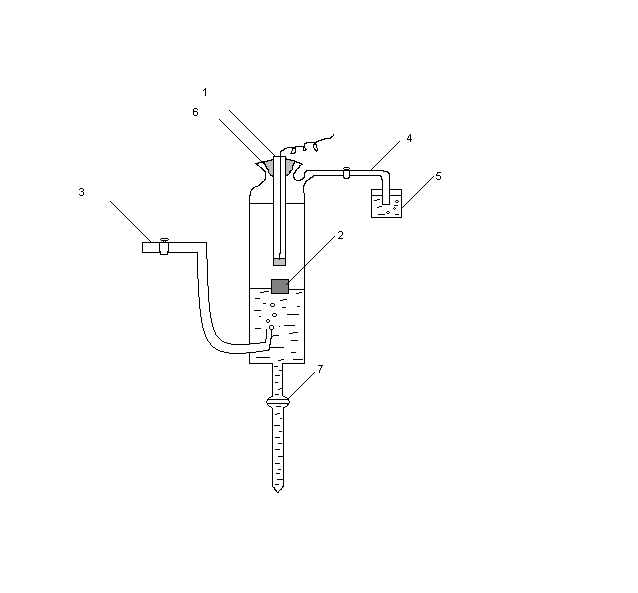
В стеклянную трубку (1) впаяна Pt (2). По трубке (3) через раствор продувается газообразный водород, который из ячейки выходит по трубке
(4) через гидрозатвор (5). Пробка (6) герметично закрывает ячейку. Платина
покрыта платиновой чернью, обеспечивающей высокую удельную поверхность границы раздела электрода с раствором, на которой устанавливается равновесие между 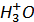 ,
, 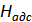 и
и 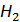 .
.
Полностью собранный, отрегулированный и насыщенный Н2 водородный электрод осторожно опустили в стакан, содержащий насыщенный раствор хлорида калия. Шлиф (7) был плотно закрыт раствором. В тот же стакан погрузили хлоридсеребряный электрод сравнения.Контактные провода отPt(Pt)-электрода и электрода сравнения подключили к высокоомному цифровому вольтметру. Предварительно проверили установку измерительного прибора «на нуль» замыканием входных клемм. Клемма (+) вольтметра соединяется с хлоридсеребряным электродом, а клемма (-) – с водородным. Сосуд заполнили контрольным раствором (NaOH (c=0,01) и HCl (c=0,01)), несколько раз измерили напряжение цепи Е(рНх).
По полученным данным вычислили pH растворов.
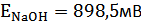 ,
,
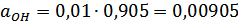
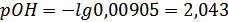
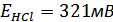 ,
,
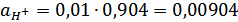
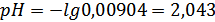
Также мы рассчитали ионное произведение воды:
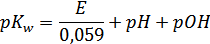
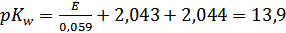 ,
,
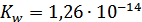 .
.
Вывод: ознакомление с конструкцией и реализация газового водородного электрода, определение с его помощью значение рН контрольного раствора
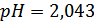 и ионное произведение воды
и ионное произведение воды 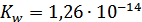 .
.
 2015-05-10
2015-05-10 514
514








