В данной работе мы определяли концентрационную константу диссоциации 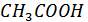 потенциометрическим методом.
потенциометрическим методом.
Для этого мы использовали стеклянный и хлоридсеребряный электроды, высокоомный вольтметр, набор стандартных растворов pH-метрии, 0,1 М раствор 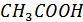 , мерную посуду.
, мерную посуду.
Первый этап нашей работы - Составление гальванической цепи, используемой для потенциометрического определения pH.
Для начала мы составили гальваническую цепь и произвели калибровку
стеклянного электрода по стандартным растворам pH-метрии с известными
значениями pH0.Результаты измерений занесли в таблицу 1 (см. приложение).
По данным этой таблицы построили график зависимости 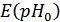 от
от 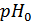
Рис. 5. Калибровка стеклянного электрода по стандартным растворам pH-метрии с известными значениями pH0
Затем методом последовательного разбавления приготовили растворы CH3COOH. Концентрации растворов:0,5; 0,2; 0,1; 0,05; 0,01; 0,005 М. Объём каждого раствора 50 см3.
Второй этап работы - измерение напряжения цепи в растворахслабой кислоты.
Составили цепь:
 Ag, AgCl | Cl- | стекло |H3O+ |Cl- | AgCl, Ag ⊕
Ag, AgCl | Cl- | стекло |H3O+ |Cl- | AgCl, Ag ⊕
Измерили напряжение цепи между стеклянным и хлоридсеребряным электродом сравнения, используя приготовленные растворы с
неизвестными значениями pH, вместо стандартных. Результаты измерений занесли в таблицу 2 (см приложение).
Измерили температуру растворов, разобрали цепь, поместили стеклянный электрод в дистиллированную воду.
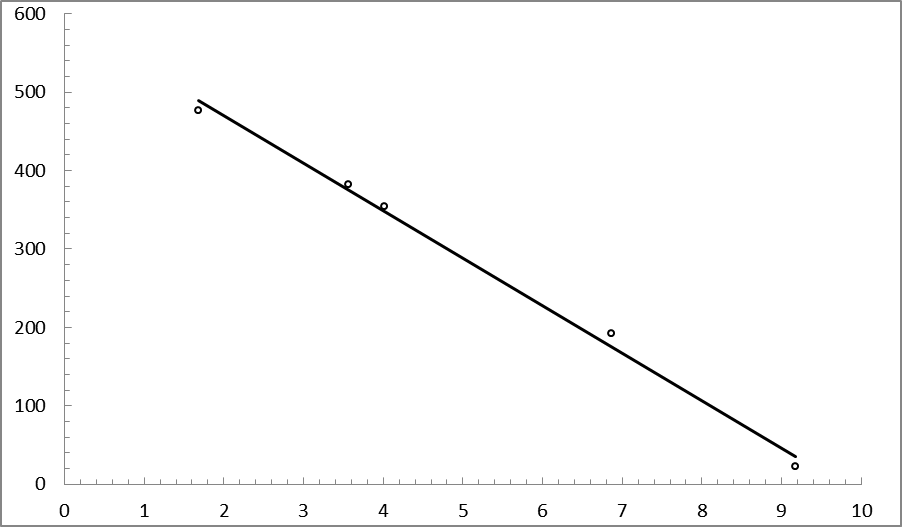
По калибровочным данным нашли значения pH всех приготовленных растворов кислоты (таблица 2), построили график зависимости 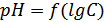
Рис. 6. Зависимость 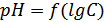
Определили наклон этой зависимости:
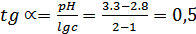 при теоретическом значении 0,5
при теоретическом значении 0,5
Экстраполяцией 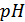 ,
, 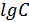 -зависимости на
-зависимости на 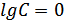 нашли величину
нашли величину
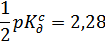
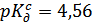
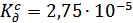 .
.
Вывод: в данной работе мы определи концентрационную константу диссоциации слабой кислоты потенциометрическим методом
 2015-05-10
2015-05-10 1310
1310








