Для начала мы собрали установку, изображённую на рис.10, но вместо стеклянного электрода в стакан для титрования ввели гладкий платиновый электрод. Перед опытом протравили его в хромовой смеси и обильно промыли дистиллированной водой.
Стакан заполнили раствором соли Мора ((NH4)2SO4∙FeSO4∙6H2O), с концентрацией 0,05 моль/дм3. Объем раствора V=20 см3.
В бюретку налили раствор перманганата калия KMnO4. Концентрация 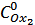 составляет 0,1 моль/дм3.
составляет 0,1 моль/дм3.
При непрерывном размешивании раствора магнитной мешалкой вели титрование, добавляя в раствор вначале по 0,2 см3, а затем по 0,1 см3 окислителя, постоянно фиксируя по вольтметру напряжение цепи между Pt-электродом и хлоридсеребряным.
Пройдя точку эквивалентности, не прекращали титрование и ввели в раствор ещё 3,5 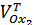 . Проделали этот опыт два раза
. Проделали этот опыт два раза
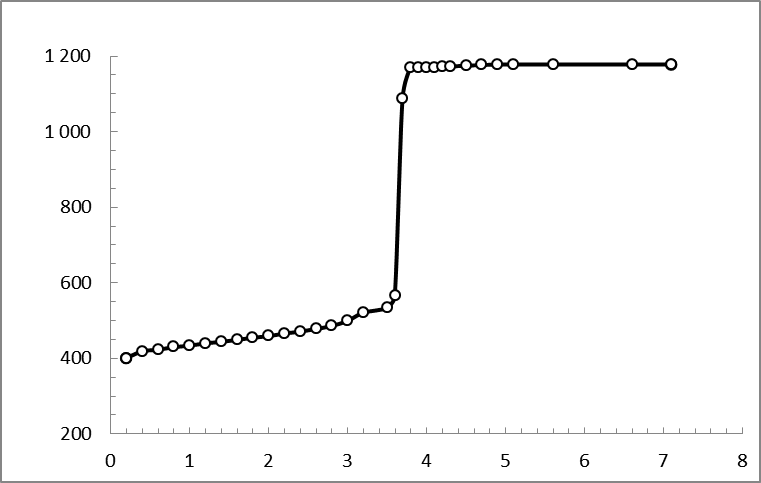
По данным таблицы 5 (см. приложение) построим график.
Рис. 11.Кривая потенциометрического титрования раствора соли Мора с концентрацией 0,05 моль/дм3 раствором перманганата калия.
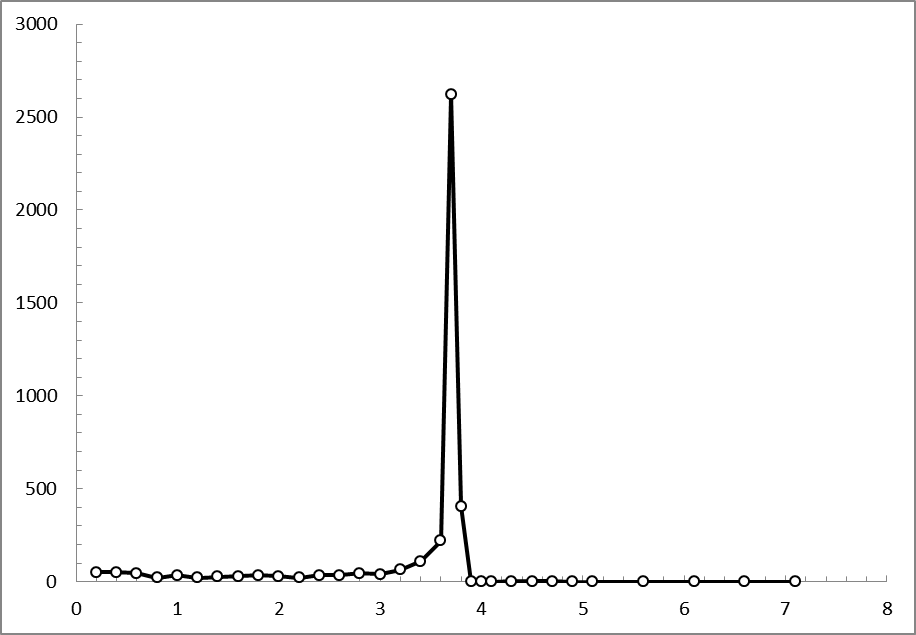
По значениям таблицы 6 (см. приложение) построили дифференциальную кривую.
Рис. 12. Дифференциальная кривая потенциометрического титрования соли Мора с концентрацией 0,05 моль/дм3 раствором перманганата калия.
Уравнение окислительно-восстановительной реакции, которая использовалась при титровании:
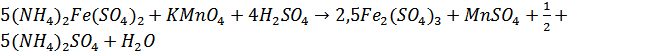 .
.
Отсюда 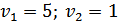
Из дифференциальной кривой титрования определили, что 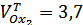 . Отсюда:
. Отсюда: 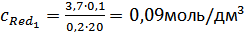 , а на самом деле исходная концентрация
, а на самом деле исходная концентрация
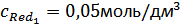 .
.
По характерным точкам на интегральной кривой титрования (рис2), нашли значения 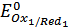 и
и 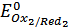 :
:
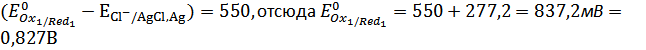 ,
,
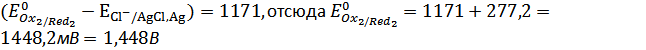 .
.
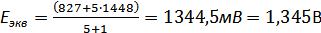 .
.
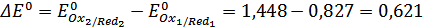 B;
B;
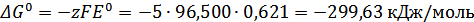 ;
;
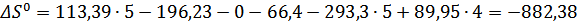 Дж
Дж
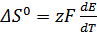 ;
;
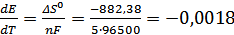
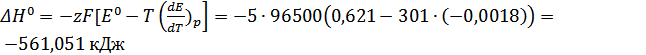 ;
;
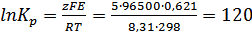 ;
;
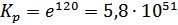
Вывод: В данной работе мы провели потенциометрическое титрование раствора соли Мора раствором перманганата калия.
Выводы
1. Ознакомились с конструкцией и реализацией стеклянного, водородного и хингидронного электродов. Провели калибровку стеклянного электрода. Определили потенциал и убедились в обратимости потенциала электрода по отношению к ионам водорода, так как зависимость линейна и угол наклона близок к теоретическому.
2. Определили концентрационную константу диссоциации  с помощью стеклянного электрода
с помощью стеклянного электрода
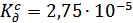
3. Так же мы провели калибровку хингидронного электрода. Зависимость E-pH линейна с наклоном 0,05. Следовательно, хингидронный электрод, как и водородный, обратим относительно ионов 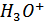 . Однако его можно применять для измерения pH растворов до 8,4 единиц, так как хингидронный электрод в щелочной среде не работает. Поэтому для нахождения константы гидролиза соли СН3СООNa мы использовали стеклянный электрод, так как он более практичен.
. Однако его можно применять для измерения pH растворов до 8,4 единиц, так как хингидронный электрод в щелочной среде не работает. Поэтому для нахождения константы гидролиза соли СН3СООNa мы использовали стеклянный электрод, так как он более практичен. 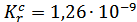
4. Определили ионное произведение воды с помощью стеклянного и водородного электродов. 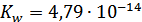 и
и 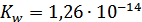 соответственно.
соответственно.
5.Провели потенциометрическое титрование раствора соли Мора раствором перманганата калия. Получили полную и дифференциальную кривую
титрования, определили концентрацию соли Мора, ошибка измерения составила 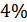 . Определили стандартные электродные потенциалы системы 1 и системы 2:
. Определили стандартные электродные потенциалы системы 1 и системы 2: 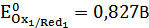 ,
, 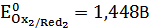 . Нашли точку эквивалентности на графике
. Нашли точку эквивалентности на графике 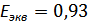 В, а по расчётам получили
В, а по расчётам получили 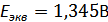 . Нашли некоторые термодинамические характеристики данной реакции:
. Нашли некоторые термодинамические характеристики данной реакции: 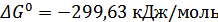 ;
; 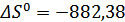 Дж;
Дж; 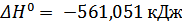 ;
; 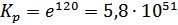 .
.
 2015-05-10
2015-05-10 1035
1035
