Недостатком модели Фишера является подразумеваемая «жесткость» каталитического центра фермента. Гораздо большей универсальностью характеризуется модель индуцированного соответствия, предложенная Кошландом. Эта модель основывается на весьма убедительных экспериментальных данных, которые подтверждают высокую степень подвижности каталитического центра. В соответствии с моделью Фишера считается, что каталитический центр заранее подогнан под структуру молекулы субстрата. В модели же индуцированного соответствия субстрат инициирует такие конформационные изменения фермента, при которых радикалы соответствующих аминокислотных остатков и другие функционально важные группы фермента принимают пространственную ориентацию, необходимую для катализа. При формировании активной конформации некоторые аминокислотные остатки могут погружаться внутрь молекулы
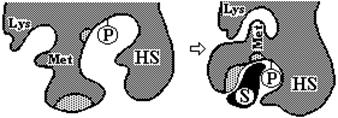 |
фермента. На рис. 5.3 схематично показаны конформационные перестройки в области активного центра фермента, индуцированные субстратом.
Рис.5.3 Схематическое представление конформационных изменений в молекуле фермента при связывании субстрата согласно модели индуцированного соответствия.
Как можно видеть, в связывании субстрата принимают участие как гидрофобные, так и заряженные радикалы аминокислот (область, обозначенная точками). В катализе непосредственно участвуют остаток фосфосерина (Р) и SH-группа цистеина. Остатки, не вовлекаемые в процессы связывания субстрата и катализа, представлены лизином - Lys и метионином - Met. В отсутствие субстрата каталитические и субстрат-связывающие группы находятся на большом расстоянии друг от друга. При добавлении субстрата, последний индуцирует соответствующие конформационные перестройки фермента, в результате которых активные группы занимают положение, необходимое для связывания субстрата и для катализа. Одновременно изменяется пространственное расположение других остатков – теперь радикалы Lys и Met оказываются сближенными.
Аналоги субстратов также могут изменять конформацию ферментов, но поскольку не любой аналог способен метаболизироваться, точно так же далеко не все конформационные изменения ферментов, индуцируемые такими аналогами, становятся активными (см. рис. 5.4).
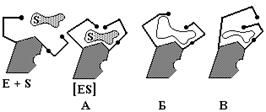 |
Рис. 5.4 Схематическое представление конформационных изменений в ферменте при связывании истинного субстрата (А) и его аналогов (Б, В).
При связывании истинного субстрата (А) функциональные группы фермента (обозначены черными точками) приобретают нужную ориентацию. Присутствие же аналога субстрата – либо более объемного (Б), либо, наоборот, меньшего по размеру (В) – индуцирует неправильное расположение этих групп. На рис. 5.4 показана еще одна структурная особенность фермента - наличие небольшой выемки в правой части. Представим, что эта выемка является регуляторной областью, предназначенной для связывания эффектора. Тогда молекула-эффектор, попадая в этот центр будет препятствовать перемещению одного из полипептидных участков фермента, который несет каталитическую группу. В результате будет иметь место связывание субстрата без катализа.
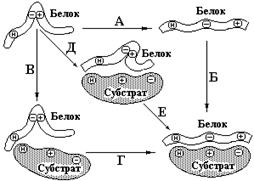 |
На рис. 5.5 приведена последовательность возможных событий, из которых складываются индуцированные субстратом конформационные изменения белка.
Рис.5.5 Схема альтернативных путей реакции при индуцировании субстратом конформационных изменений в ферменте. Сначала фермент претерпевает конформационное изменение (А), затем связывает субстрат (Б). В другом случае фермент сначала связывает субстрат (В), а затем претерпевает конформационное изменение (Г). Наконец, оба процесса могут раз-виваться согласованным образом (Д) с образованием конечной конформации (Е).
Предположим, что известна полная первичная структура какого-либо фермента. Но даже в этом случае обычно бывает трудно решить, из каких именно аминокислотных остатков формируется каталитический центр. Как явствует из модели индуцированного соответствия, эти остатки могут располагаться далеко один от другого в полипептидной цепи, однако они оказываются сближенными в трехмерной (третичной) структуре. Например, в формировании активного или каталитического центра могут принимать участие аминокислотные остатки, принадлежащие нескольким спирализованным сегментам полипептидной цепи, как это имеет место в случае гемоглобина или химотрипсина.
 2015-05-12
2015-05-12 2403
2403
