Небольшие изменения значения рН в реакционной смеси оказывают определенное влияние на ионное состояние фермента, а часто и субстрата. Как показывают измерения активностей ферментов или скоростей ферментативных реакций при различных рН, оптимальная активность обычно наблюдается в интервале рН 5,0-9,0. Вместе с тем отдельные ферменты активны при значениях рН, лежащих далеко за пределами этого интервала, например пепсин активен при рН 1,5-2,0.
В основном влияние рН на активность ферментов выражается в следующих проявлениях: денатурации фермента при очень высоких или очень низких значениях рН и изменении величины заряда молекул субстрата или фермента. Активность фермента при увеличении или уменьшении рН может изменяться в результате изменений его структуры, либо заряда функционально важных групп, принимающих участие в катализе или связывании субстрата. Рассмотрим для примера взаимодействие фермента, несущего отрицательный заряд (E–) с положительно заряженным субстратом (SH +):
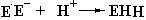 |
При низких значениях рН происходит протонирование фермента Eˉ:
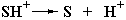 |
а при высоких значениях рН – депротонирование субстрата SH+:
Поскольку взаимодействовать друг с другом могут только SH+ и Eˉ, при крайних значениях рН эффективные концентрации Eˉ или SH+ окажутся низкими, что в любом случае приведет к снижению скорости реакции (см. рис. 5.7).
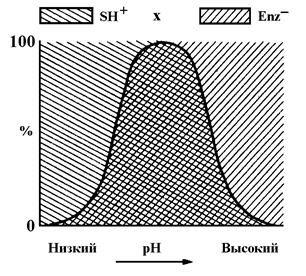
Рис.5.7 Влияние рН на активность фермента.
Как следует из рис. 5.7, только в области, выделенной двойной штриховкой, при соответствующих значениях рН в активном ионном состоянии находятся одновременно E и S. Максимальной концентрации активные ионные состояния E и S достигают при рН в точке X.
Величина рН может оказывать регуляторное действие на конформационное состояние белков и ферментов. Поддержание активной третичной или четвертичной структуры часто зависит от присутствия определенного заряда на конкретной группе, даже сильно удаленной от области связывания субстрата. Изменение заряда этой группы может привести к частичному разворачиванию белковой молекулы или, наоборот, к ее компактизации, или даже к диссоциации олигомерного белка на протомеры, что во всех случаях сопровождается потерей активности.
 2015-05-12
2015-05-12 587
587








