ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ
ОСНОВЫ МОЛЕКУЛЯРНО – КИНТИЧЕСКОЙ ТЕОРИИ ГАЗОВ
Краткая теория
Идеальным называется газ, между молекулами которого отсутствуют силы взаимного притяжения. Принимается, что при соударениях молекулы такого газа ведут себя как абсолютно упругие шарики исчезающе малых размеров. Эти два условия являются критериями идеальности газа.
Эксперименты показали, что реальные газы при не слишком низких температурах и достаточно малых давлениях по своим свойствам близки к идеальным газам. Так, например, водород и, в особенности, гелий уже при атмосферном давлении и комнатной температуре ведут себя практически как идеальные газы.
Прежде всего рассмотрим подробнее основные параметры состояния газов. Не останавливаясь на объеме газа, который всегда совпадает с объемом V сосуда, в который газ помещен, определим параметры р и Т.
Давлением р называется физическая величина, численно равная силе, действующей на единицу площади поверхности по нормали к ней:
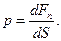 | (6.1) |
Если давление постоянно везде на поверхности S, то
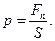 | (6.2) |
Температура характеризует степень нагретости тела. В обыденной жизни очень часто используется понятие температуры, и мы «привыкли» к нему. Для измерения температуры можно использовать хорошо известный факт, что при нагревании или охлаждении тела изменяются почти все его физические свойства: длина и объем, плотность, упругие свойства, электропроводность и т. д. Изменение любого из этих свойств может служить основой для измерения температуры, если только известна, хотя бы для одного, так называемого термометрического тела, функциональная зависимость данного свойства от температуры.
Температура измеряется в °С (градус стоградусной шкалы или градус Цельсия) и обозначается через t, причем принимается, что при нормальном давлении в 1,01325 × 105 Н/м2 температуры плавления льда и кипения воды равны соответственно 0° С и 100° С.
В 1954 г. Десятая генеральная конференция по мерам и весам установила абсолютную термодинамическую температурную шкалу, в которой температура измеряется в °К (градус Кельвина) и обозначается через Т. Связь между абсолютной температурой Т итемпературой t по стоградусной шкале имеет вид:
| Т = 273,15 + t | (6.3) |
Температура Т = 0 (по стоградусной шкале — 273,15° С) называется абсолютным нулем температуры.
Термодинамическим процессом называется всякое изменение состояния термодинамической системы.
Термодинамической системой называется совокупность макроскопических объектов (тел или полей), обменивающихся энергией в форме работы и в форме тепла как друг с другом, так и с внешней средой, то есть с внешними по отношению к системе телами и полями.
Изопроцессами называются термодинамические процессы, протекающие при неизменном значении какого-либо параметра состояния (масса системы предполагается постоянной).
Рассмотрим законы идеальных газов.
1. Р. Бойлем и Э. Мариоттом экспериментально был установлен: закон (изотермический): произведение численных значений давления и объема газа есть величина постоянная при неизменных температуре и массе газа:
| pV = const. | (6.4) |
Эксперименты показали, что реальные газы подчиняются этому закону тем точнее, чем меньше их плотность.

Рис. 6.1. Наглядное изображение изотермического процесса на диаграммах PV, PT, VT
Закон Гей-Люссака (изобарический):
а) давление данной массы газа при постоянном объеме изменяется линейно с изменением, температуры:
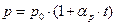 , , | (6.5) |
где р0 — давление газа при температуре t = 0° С; αp – термический коэффициент давления.
б) объем данной массы газа при постоянном давлении изменяется линейно с изменением температуры:
| V = V0 × (1 + av ×t), | (6.6) |
где V0 - объем газа при температуре t = 0° С, или V1/V2 = T1/T2, av - термический коэффициент объемного расширения.

Для сильно разреженных газов, ведущих себя подобно идеальным газам, термические коэффициенты давления αp и объемного расширения av, близки к 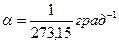 . Во всех остальных случаях αp и av несколько различны даже для одного и того же газа (например, для СО2 av больше αp на 0,4 %), не говоря уже о том, что они неодинаковы для различных газов и зависят от состояния газа (его давления и температуры).
. Во всех остальных случаях αp и av несколько различны даже для одного и того же газа (например, для СО2 av больше αp на 0,4 %), не говоря уже о том, что они неодинаковы для различных газов и зависят от состояния газа (его давления и температуры).
 |
Рис. 6.2. Наглядное изображение изобарического процесса
Закон Шарля (изохорический):
| p = p0 + a×t, при р1/р2 = Т1/Т2 при V = const, m = const, | (6.7) |
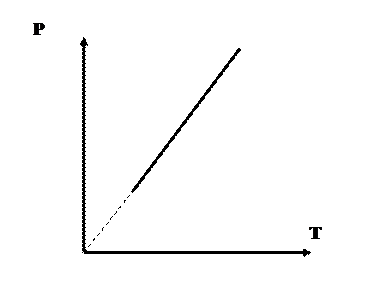
Рис. 6.3. Наглядное изображение изохорического процесса
Килограмм - молекулой, или килограмм - молем (кмоль), называется такое количество вещества, масса которого, выраженная в килограммах, численно равна его молекулярному весу m (М = m). Грамм - молекулой, или грамм-молем (моль), называется количество вещества, масса которого, выраженная в граммах, численно равна его молекулярному весу. Число молекул NA, содержащееся в одном килограмм - моле, равно отношению массы килограмм - моля μ к массе m одной молекулы, выраженной в кг:
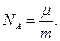 | (6.8) |
Из определения молекулярного веса следует, что для двух разных веществ 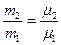
и
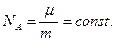 | (6.9) |
Таким образом, мы пришли к выводу о том, что килограмм - моли различных веществ содержат одинаковое число молекул, называемое числом Авогадро (NА = 6,023 ×1023 1/молъ).
А. Авогадро был установлен закон, по которому килограмм - моли различных газов при одинаковых давлениях и температурах занимают одинаковые объемы. Так, при нормальных условиях (Т = 273,15° К и р = 1,0132 × 106 Н/м2 = 1 атм = 760 мм. рт. cm.) 1 кмолъ любого газа занимает объем 22,415 м3.
 2015-05-13
2015-05-13 994
994







