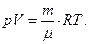
| (6.10) |
где р – давление; V – объем; Т – термодинамическая температура; М – молярная масса газа; R = 8,31 Дж/(мольּ∙К) – молярная газовая постоянная; m/М = ν – количество вещества.
Уравнение (6.10) представляет собой наиболее общую форму записи уравнения состояния идеального газа. Введем так называемую постоянную Больцмана k, равную отношению универсальной газовой постоянной R к числу Авогадро NА:
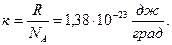
| (6.11) |
Основное уравнение кинетической теории газов:
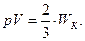
| (6.12) |
Из него следует, что произведение численных значений давления идеального газа и его объема равно двум третям величины кинетической энергии поступательного движения всех его молекул. Для однородного газа массы всех молекул одинаковы (m1 = m0), а скорости 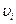 различны. Поэтому
различны. Поэтому 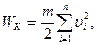 и становится целесообразным ввести понятие средней квадратичной скорости.
и становится целесообразным ввести понятие средней квадратичной скорости.
Средней квадратичной скоростью υКВ поступательного движения молекул газа называется корень квадратный из среднего арифметического квадратов скоростей поступательного движения всех его молекул:
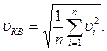
| (6.13) |
С другой стороны, по уравнению Менделеева — Клапейрона (6.10):
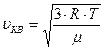
| (6.14) |
Поскольку m = m0NА, где m0 - масса одной молекулы, a NА - число Авогадро, то из уравнения (6.14) следует, что
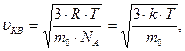
| (6.15) |
где k - постоянная Больцмана.
Средняя кинетическая энергия поступательного движения молекулы идеального газа:
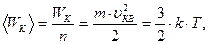
| (6.16) |
где k – постоянная Больцмана.
Таким образом, абсолютная температура является мерой средней кинетической энергии поступательного движения молекул идеального газа. Однако в области температур, близких к абсолютному нулю, этот результат оказывается неверным.
 |
Рис. 6.4. Графическое изображение зависимости средней кинетической энергии поступательного движения молекулы идеального газа от температуры
Закон распределения молекул по скоростям имеет следующий вид:
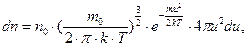
| (6.17) |
где m - масса молекулы; k - постоянная Больцмана; Т - абсолютная температура; n0 – число молекул газа в единице объема; u – скорость.
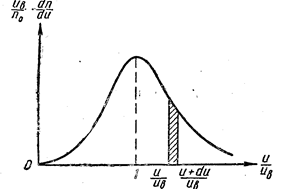
Рис. 6.5. Кривая закона распределения молекул по скоростям
Закон максвелловского распределения молекул по скоростям может быть записан также в виде:
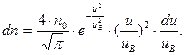
| (6.18) |
Закон распределения скоростей позволяет подсчитать величину средней арифметической скорости и поступательного движения молекул идеального газа. Расчет приводит к следующей формуле:
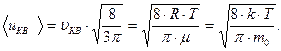
| (6.19) |
Таким образом, существуют три скорости, характеризующие состояние газа:
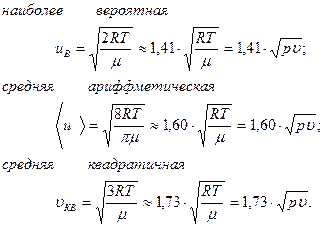
| (6.20) |
Закон Дальтона для давления смеси n идеальных газов
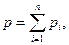
| (6.21) |
где pi – парциальное давление i -го компонента смеси.
 2015-05-13
2015-05-13 534
534








