ph = p0 × e- m× g×(h – h 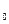 )/(R×T), )/(R×T), | (6.22) |
где ph и p0 – давление газа на высоте h и h0, m – масса молекулы газа.
Уравнение состояния реальных газов (уравнение Ван – дер – Ваальса) для одного моля газа
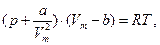 | (6.23) |
для произвольного количества вещества v газа.
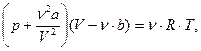 | (6.24) |
где а и b - постоянные Ван-дер-Ваальса (рассчитанные на один моль газа); V - объем, занимаемый газом; Vm - молярный объем; р -давление газа на стенки сосуда.
При критической температуре (Т = ТК) разность молярных объемов сухого насыщенного пара и жидкости становится равной нулю. В критической точке значение давления, молярного объема и температуры называются критическими параметрами.
ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ
6.1. Определение идеального газа.
6.2. Определение давления.
6.3. Определение температуры.
6.4. Абсолютная термодинамическая шкала.
6.5. Абсолютная температура.
6.6. Абсолютный нуль температуры.
6.7. Определение термодинамического процесса.
6.8. Определение термодинамической системы.
6.9. Определение изопроцесса.
6.10. Закон Бойля – Мариотта.
6.11. Закон Гей -Люссака.
6.12. Закон Шарля.
6.13. Определение киллограмм – моля.
6.14. Определение грамм – моля.
6.15. Определение постоянной Авогадро.
6.16. Закон Авогадро.
6.17. Определение постоянной Больцмана.
6.18. Уравнение состояния идеального газа.
6.19. Основное уравнение молекулярно – кинетической теории газов.
6.20. Закон Дальтона.
6.21. Определение средней квадратичной скорости молекул.
6.22. Средняя кинетическая энергия поступательного движения молекул.
6.23. Закон Максвелла для распределения молекул идеального газа по скоростям.
6.24. Определение средней арифметической скорости молекул.
6.25. Барометрическая формула.
6.26. Уравнение состояния реального газа.
АЛГОРИТМ РЕШЕНИЯ ЗАДАЧ ПО ТЕМЕ: «МОЛЕКУЛЯРНО – КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ»
1. Записать уравнения, позволяющие определить неизвестные физические величины.
2. Решить полученную систему уравнений.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ ПО ТЕМЕ: «МОЛЕКУЛЯРНО – КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ»
Задача 6.1. В сосуде находится масса m1 = 10 г углекислого газа и масса m2 = 15 г азота. Найти плотность r смеси при температуре t = 270 С и давлении р = 150 кПа.
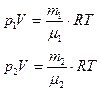   Дано: m1 = 10 г = = Дано: m1 = 10 г = = 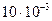 кг m2 = 15 г = = кг m2 = 15 г = = 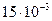 кг t = 270 С р = 150 кПа = = кг t = 270 С р = 150 кПа = = 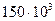 Па Па | Решение: 1. Согласно уравнению (6.21) имееем: р = р1 + р2 (1) где р1 – парциальное давление углекислого газа, р2 - парциальное давление азота. 2. Согласно уравнению (6.10) имеем: (2) (3) |
| Найти: r -? |
3.Складывая (2) и (3), с учетом (1), имеем:
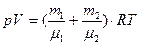 (4)
(4)
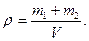 4. Плотность смеси равна:
4. Плотность смеси равна:
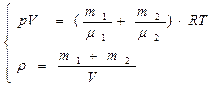 |
5. Решая совместно систему уравнений:
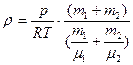 |
Получаем:
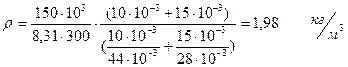 6.Вычисления производим в Международной системе единиц СИ.
6.Вычисления производим в Международной системе единиц СИ.
вычисления:
Ответ: r = 1,98 кг/м3.
Задача 6.2. Во сколько раз число молекул DN1, скорости которых лежат в интервале от nВ до nВ + Dn, больше числа молекул DN2,, скорости которых лежат в интервале от 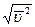 до
до 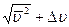 ?
?
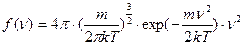   Дано: nВ nВ + Dn Дано: nВ nВ + Dn | Решение: 1. Согласно уравнению (6.18) имеем: (1) 2. Относительное число молекул, скорости которых лежат в интервале от nВ до nВ + Dn, равно |
| Найти: DN1/ DN2 -? |
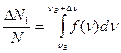 (2)
(2)
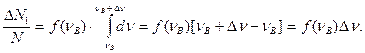 3. Если Dn << nВ то функция f(n) на данном интервале равна f (n) = const.
3. Если Dn << nВ то функция f(n) на данном интервале равна f (n) = const.
4. Из (2) имеем:
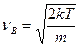 |
5. Согласно уравнению (6.20), имеем:
6. Согласно уравнениям (1) и (2) можно получить:
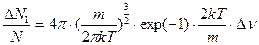
(3)
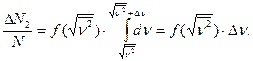 7. Аналогично во втором случае, согласно уравнениям (1) и (2) можно получить:
7. Аналогично во втором случае, согласно уравнениям (1) и (2) можно получить:
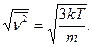
8. Согласно уравнению (6.20) имеем:
9. Тогда
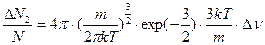
(4)
10. Разделив уравнение (3) на (4), получаем искомое отношение:
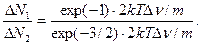
(5)
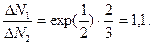 Вычисления производим в Международной системе единиц СИ:
Вычисления производим в Международной системе единиц СИ:
Ответ: 1,1.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
6.1. В сосуде находится количество n1 = 10-7 молей кислорода и масса m2 = 10-6 г азота. Температура смеси t = 1000 С, давление в сосуде р = 133 мПа. Найти объем V сосуда, парциальные давления р1 и р2 кислорода и азота и число молекул n в единице объема сосуда.
(Ответ: n = 2,6×1019 м-3).
6.2. В закрытом сосуде объемом V = 1 м3 находится масса m1 = 1,6 кг кислорода и масса m2 = 0,9 кг воды. Найти давление р в сосуде при температуре t = 500° С, зная, что при этой температуре вся вода превращается в пар.
(Ответ: р = 640 кПа)
6.3. В сосуде 1 объем V1 = 3 л находится газ под давлением p1 = 0,2 МПа. В сосуде 2 объем V2 = 4 л находится тот же газ под давлением р2 = 0,1 МПа. Температуры газа в обоих сосудах одинаковы. Под каким давлением р будет находиться газ, если соединить сосуды 1 и 2 трубкой?
(Ответ: р = 140 кПа).
 6.4. Найти среднюю арифметическую
6.4. Найти среднюю арифметическую 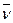 , среднюю квадратичную
, среднюю квадратичную 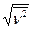 и наиболее вероятную nВ скорости молекул газа, который при давлении р = 40 кПа имеет плотность r = 0,3 кг/м3.
и наиболее вероятную nВ скорости молекул газа, который при давлении р = 40 кПа имеет плотность r = 0,3 кг/м3.
(Ответ: 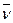 = 579 м/с; nВ = 513 м/с;
= 579 м/с; nВ = 513 м/с; 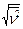 = 628 м/с).
= 628 м/с).
6.5. Какая часть молекул кислорода при t = 00 C обладает скоростями n от 100 до 110 м/с?
(Ответ: DN/N = 0,4%).
6.6. Какая часть молекул азота при температуре Т имеет скорости, лежащие в интервале от nВ до nВ + Dn, где Dn = 20 м/с, если: а) Т = 400 К; б) Т = 900 К?
(Ответ: DN/N = 3,4 %; DN/N = 2,2 %).
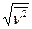 6.7. В сосуде находится масса m = 2,5 г кислорода. Найти число NX молекул кислорода, скорости которых превышают среднюю квадратичную скорость
6.7. В сосуде находится масса m = 2,5 г кислорода. Найти число NX молекул кислорода, скорости которых превышают среднюю квадратичную скорость
(Ответ: N1 = 1,905×1022).
6.8. Две сферы объемом 200 и 100 см3 соединены короткой трубкой (см. рисунок), в которой имеется изолирующая пористая перегородка. С ее помощью можно добиться равенства давлении в сосудах, но не температуры. Система находится при t = 27° С и содержит кислород под давлением 760 мм рт. ст. Малая сфера помещается в сосуд со льдом при 0° С, а большая — в сосуд с паром при 100° С. Какое давление установится в системе? Тепловым расширением сфер пренебречь.
(Ответ: Р = 842 мм рт. ст.)
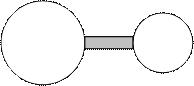 |
Рисунок к задаче 6.8.
6.9. Резервуар на 50 л соединен с резервуаром на 15 л с помощью короткой трубки, в которой имеется специальный клапан давления, позволяющий газу просачиваться из большого резервуара в малый, если давление в большом превышает давление в меньшем на 88 см рт. ст. При t = 17° С больший резервуар содержит газ при атмосферном давлении, а меньший — полностью вакуумирован. Каково будет давление в последнем, если оба резервуара нагреть до 162° С?
(Ответ: Р2 = 200 мм рт. ст).
6.10. Какая доля молекул газа (газ находится в тепловом равновесии), достигающих в единицу времени поверхности сосуда, обладает кинетической энергией:
а) большей, чем средняя тепловая,
б) в 3 раза большей, чем средняя тепловая?
(Ответ: 0,55; 0,061)
 2015-05-13
2015-05-13 1468
1468







