Он происходит при постоянном удельном объеме (u = const), так что du = 0 и газ не совершает работы над внешними телами:
| dА = pdV = 0. | (7.10) |
При изобарическом процессе:
Для произвольной массы m газа количество теплоты, необходимое для нагревания газа от температуры Т до температуры Т + dT, вычисляется по формуле:
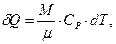
| (7.11) |
где m - молекулярный вес газа, Ср - его молярная теплоемкость при постоянном давлении.
Работа, которую совершает единица массы газа при изобарическом расширении от состояния 1 до состояния 2, выражается следующим образом:
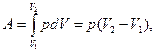
| (7.12) |
где р – давление; V1 – начальный объем газа; V2 – конечный объем газа.
На рис.7.1. она изображается площадью заштрихованного прямоугольника V1 l2 V 2.

Рис.7.1. Работа при изобарном процессе
при изотермическом процессе (D U = 0):
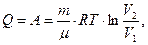
| (7.13) |
где Q – теплота; А – работа, совершаемая газом; m – масса газа; µ - молекулярный вес газа; R – универсальная газовая постоянная; Т – температура газа; V1 – начальный объем газа; V2 – конечный объем газа.
Помимо рассмотренных процессов в газах, большой практический интерес представляет адиабатический (адиабатный) процесс. Он широко применяется в циклах двигателей внутреннего сгорания, холодильных установках и т. д. Процесс, совершаемый системой, называется адиабатическим, если в нем отсутствует обмен энергией в форме теплоты (теплообмен) между системой и внешней средой. Адиабатический процесс подчиняется условию dQ = 0:
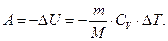
| (7.14) |
Уравнение Пуассона (уравнение газового состояния при адиабатическом процессе):
| PVg = const, TVg-1= const, Tg p1-g = const. | (7.15) |
 2015-05-13
2015-05-13 366
366








