ОСНОВЫ ТЕРМОДИНАМИКИ
Изучая движение тела как целого, мы могли в механике ограничиться рассмотрением его кинетической энергии WК и потенциальной энергии WП в поле внешних сил. В явлениях, изучаемых молекулярной физикой, определяющую роль играют взаимодействие и внутреннее движение частиц тела или системы тел. Следовательно, изучая термодинамическую систему, необходимо учитывать не только механическую энергию системы как целого (кинетическую WК и потенциальную WП), но и анергию U движения и взаимодействия микрочастиц этой системы (молекул, атомов, электронов и т. д.), называемую внутренней энергией системы. Внутренняя энергия идеального газа:
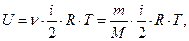
| (7.1) |
Полная энергия W системы равна:
| W = WК + WП + U. | (7.2) |
В зависимости от характера движения и взаимодействия частиц, образующих тела, внутреннюю энергию можно разбить на следующие составные части:
а) кинетическую энергию хаотического движения молекул (поступательного и вращательного);
б) потенциальную энергию, обусловленную силами межмолекулярного взаимодействия;
в) кинетическую и потенциальную энергии колебательного движения атомов в молекуле;
г) энергию электронных оболочек атомов и ионов, а также внутриядерную энергию.
Первый закон (или начало) термодинамики является выражением одного из основных законов природы, в достаточно общей форме этот закон может быть сформулирован так: изменение DW полной энергии системы при переходе ее из одного состояния в другое равно сумме совершенной над системой (затраченной) работы А' и сообщенной ей теплоты Q:
| DW = A¢ + Q. | (7.3) |
Если вместо затраченной работы А' ввести равную ей по величине, но противоположную по знаку работу А, совершенную системой над внешними телами (А = -А'), то вместо (7.3) получим:
| Q = DU + А. | (7.4) |
Отсюда вытекает следующая формулировка первого начала термодинамики: теплота, сообщаемая системе, расходуется на увеличение ее внутренней энергии и на совершение системой работы против внешних сил.
Очень важным является случай, когда система представляет собой периодически действующую машину, в которой газ, пар или другое «рабочее тело» в результате некоторого процесса возвращается в первоначальное состояние. В этом случае DW, а следовательно, и DU равны нулю, так что А = Q.
Этот вывод позволяет сформулировать первый закон термодинамики следующим образом: нельзя построить периодически действующий двигатель, который совершал бы работу без подвода энергии извне или совершал бы работу, большую, чем количество сообщенной ему извне энергии (вечный двигатель первого рода невозможен).
Выражение (7.4) удобнее записывать для малого изменения состояния системы, вызванного сообщением ей малого количества теплоты dQ и совершением системой элементарной работы dА:
| dQ = dU + dA | (7.5) |
Большую роль в изучении тепловых свойств вещества играет понятие теплоемкости. Удельной теплоемкостью с называется физическая величина, численно равная количеству теплоты, которое надо сообщить единице массы этого вещества для увеличения ее температуры на 1 ° К:
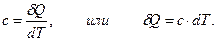
| (7.6) |
Кроме того, часто пользуются молярной (мольной) теплоемкостью С, которая в отличие от удельной теплоемкости, отнесена не к единице массы (кг), а к одному килограмм-молю вещества. Очевидно, что:
| С = m × с, | (7.7) |
где m — молекулярный вес вещества.
Молярные теплоемкости газа при постоянном объеме и постоянном давлении соответственно равны:
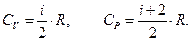
| (7.8) |
где i – степень свободы (для одноатомного газа i =3; для двухатомного газа i = 5; для многоатомного газа i = 6).
Числом степеней свободы механической системы называется количество независимых величин, с помощью которых может быть задано положение системы в пространстве.
 2015-05-13
2015-05-13 470
470







