Ранее было описано 8 групп комплементации FA, но как и при АТ их число изменилось. Описанная ранее как редкая группа комплементации FAD1 оказалась результатом гомозиготной мутации гена BRCA2, приводящей к синтезу этого белка без крайнего участка С-конца. Эта группа больных характеризуется не только симптомами FA, но и высоким риском возникновения рака молочной железы, что отличает ее от типичных случаев. Другие гены (A, C, D2, Е, F, G,) тоже клонированы. Все они вместе способны образовывать единый ядерный комплекс и связываться с белком BRCA1, с которым обнаруживаются колокализованными в ядре. Вероятно, они участвуют в одном и том же сигнальном пути, активирующемся в ответ на образование поперечных ДНК-сшивок и остановку репликации. Существуют данные еще о двух группах комплементации – связанной с Х-хромосомой FAB и еще одном вероятном участнике того же самого общего ядерного комплекса FAL (именно этот белок представляется необходимым для убиквитинирования FAD2). Схематически все эти взаимодействия белков FA между собой представлены на рис. 31.
Димер FANCD2 напрямую фосфорелируется белком АТМ, и это необходимая составляющая чек-пойнта S-фазы в клеточном ответе на ионизирующее облучение. Нормальное функционирование белков FA необходимо для сохранения хромосомной стабильности в течение S- и G2-фаз клеточного цикла. Для осуществления этой функции, необходимо моноубиквитинирование белка FAD2 по лизину-561, которое осуществляется комплексом белков BRCA1/BARD1 прит обязательном участии общего ядерного комплекса всех остальных FA-белков. Схема процесса показана на рис. 32.
На рис. 32 показано, что шаги a-е важны для обнаружения ДНК-повреждений и активации чекпойнт-ответа. Репарация повреждений, останавливающих репликацию (о которой мы будем подрорбнее говорить позже) может осуществляться с помощью рекомбинации без ошибок (ж) или с помощью синтеза на поврежденной матрице, который может сопровождаться мутациями (з). Вероятно, фосфорелирование или убиквитинирование белка FAD2 может быть важным для выбора между этими путями репарации.
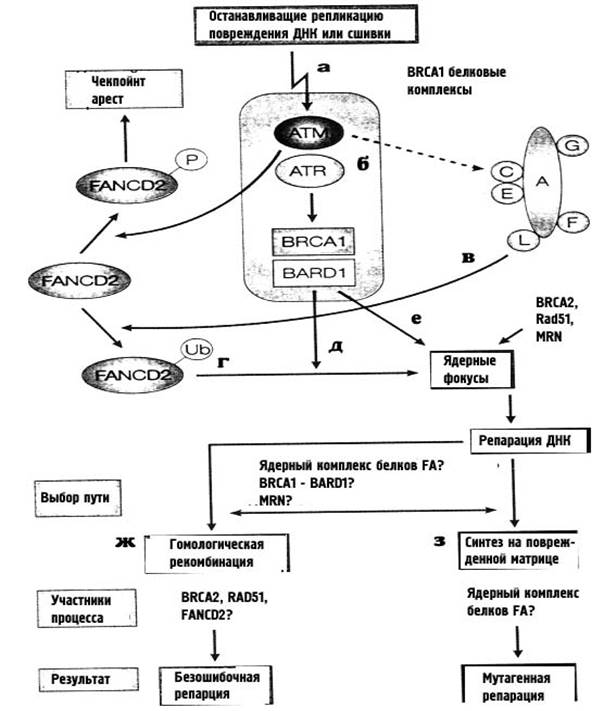
Рисунок 32. Роль белков анемии Фанкони в сохранении клеткой хромосомной стабильности
10.1. Защитники генома. Белок Р53.
Многократно упоминаемый ранее белок Р53 играет большую роль в репарации двунитевых разрывов и может влиять на выбор пути репарации между HHR и NHEJ. Многофакторная роль белка Р53 в репарации, контроле клеточного цикла и апоптозе делает крайне сложным выделение именно роли в репарации DSBs. Было показано, что Р53 способен связываться как с однонитевой так и с двунитевой ДНК в том месте, где прогисходит нуклеазная 3’-5’ расчистка и способствует отжигу гомологов. Так же он способен связываться с мисмэтчами и трехнитевыми структурами, а также с холлидеевскими структурами, способствуя их разрешению. При этом он связывается с комплексами BRCA2 с WRN и BLM, регулируя геликазные активности WRN и BLM.
Как уже говорилось, в условиях нормального функционирования в клетке содержание и активность р53 невелики. Хотя в некоторых типах клеток содержание р53 и может быть заметным, он находится в неактивной латентной форме. Латентная форма р53 лишена способности активировать транскрипцию р53-респонсивных генов. Это не означает, однако, что, находясь в латентной форме, р53 полностью лишен какой-либо активности. Возможно, в такой форме он играет какую-то роль именно в процессах репарации ДНК. В частности, было обнаружено, что латентная форма р53, лишенная способности связываться с ДНК, может узнавать участки одноцепочечной ДНК, неспаренные основания, а также имеет повышенную 3'-5'-экзонуклеазную активность. Напротив, активированная форма р53 утрачивает экзонуклеазную активность, но приобретает способность связываться с ДНК.
Активация гена р53 происходит под действием повреждения ДНК. При этом, несмотря на то, что в регуляторной области промотора гена р53 имеются участки связывания некоторых транскрипционных факторов, изменения транскрипции самого гена р53 происходят редко. Существенная активация гена р53 на транскрипционном уровне известна только для ранних эмбрионов, а также для недифференцированных эмбриональных тератокарцином, где уровень мРНК р53 повышен на порядок по сравнению с клетками взрослого организма.
Накопление р53 в ответ на стрессы происходит даже в присутствии ингибиторов синтеза РНК и белка, что говорит о его послетрансляционном характере. При этом происходит значительная стабилизация р53.
Кроме количественного накопления р53 происходят также глубокие качественные изменения белковой молекулы, сопровождающиеся ее переходом от латентного в функционально-активное состояние. Эти изменения происходят за счет фосфорилирования, дефосфорилирования, ацетилирования, метилирования и гликозилирования различных участков белковой молекулы, а также за счет образования ковалентных и нековалентных комплексов с другими белками. Многообразие участков модификации и факторов, взаимодействующих с р53, обеспечивает тонкую регуляцию его активности. Активация р53 не является необратимой, поскольку имеются механизмы обратной связи, позволяющие вернуть р53 в менее активное или латентное состояние после преодоления дефектов и сбоев в работе клетки.
Основное фосфорелирование белка Р53 по серину в 15 положении проводит белок АТМ. Вероятно, в этом процессе каким-то образом участвует и белок BARD1, способствуя этой стабилизации.
Для функционирования р53 как фактора транскрипции требуется его взаимодействие с ДНК. Модификация С-концевой части молекулы, индуцируемая разнообразными стрессовыми механизмами, сопровождается конформационной перестройкой и приобретением белком способности связываться с ДНК. Но для начала транскрипции требуется сложное взаимодействие N-концевой транскрипционно-активаторной части р53 с компонентами транскрипционного аппарата - белками комплекса TFIID - ТВР (ТАТА-Вох Binding Protein) и ТВР-ассоциированными факторами TAFII. Небольшой гидрофобный участок р53 вокруг Leu-22 и Тгр-23 отвечает за взаимодействие сразу с несколькими белками транскрипционного аппарата. Кроме того, для активации специфических промоторов в комплексе с TFIID должны присутствовать транскрипционные коактиваторы - CREB-binding protein (СВР) и близкородственный ему белок рЗОО. рЗОО/СВР обладает гистон-ацетил-трансферазной активностью. Ацетилирование гистонов играет важную роль в модуляции структуры хроматина при активации транскрипции, увеличивая доступность хроматина для транскрипционного аппарата. рЗОО/СВР способен напрямую взаимодействовать с комплексом РНК-полимеразы II и таким образом служить проводником, обеспечивающим инициацию транскрипции в ответ на связывание транскрипционного фактора. N-Концевой трансактивационный домен р53 также взаимодействует с рЗОО/СВР.
Некоторые сигналы, например, γ-излучение, приводят к стабилизации белка Р53 с одновременным увеличением уровня белка Р53 в устойчивом состоянии. В клетках больных АТ нарушен путь регуляции «сверху» этого процесса (нет фосфорелирования белка Р53 пртеинкиназой АТМ), что приводит к отсутствию стабилизации Р53 и остановки клеточного роста в ответ на радиационные повреждения ДНК. В негативном пути регуляции повышение уровня Р53 приводит через взаимодействие с ТВР к супрессии транскрипции генов, усиливающих рост клеток, что ведет к ингибированию пролиферации. Мутантный Р53 не может супрессировать транскрипцию и таким образом ингибировать экспрессию генов, отвечающих за клеточный рост, которые поддерживают пролиферацию. В позитивном регуляторном пути повышение уровня белка Р53 дикого типа приводит к стимуляции транскрипции генов, которые вовлечены в процессы репарации ДНК и тех, которые негативно регулируют клеточный рост, что приводит к остановке клеточного цикла в фазе G1.
На рис. 33 изображено, как именно может работать Р53 в качестве антионкогена.
Продукт гена mdm2 является клеточным регулятором функций Р53 дикого типа и находится под его положительным контролем. Возрастание уровня MDM2 действует по принципу отрицательной обратной связи на возросший уровень Р53 в системе авторегуляции этого белка, которая при вовлечении белка Р53 в комплекс с MDM2 способна снять блок с продвижения клетки по циклу. Увеличение экспрессии MDM2 из-за разрегулирования экспрессии или в результате амплификации может приводить к опухолеобразованию. К тому же многие продукты ДНК онковирусов, например полноразмерный антиген вируса SV-40, 55кд белок аденовируса Е1В и продукт гена папилломы человека Е6 ингибируют трансактивацию белка Р53 дикого типа и, блокируя таким образом функции Р53, могут частично способствовать канцерогенезу. Другие сигналы также могут влиять на клеточный рост и опухолеобразование через посредство Р53 дикого типа. Например, продукт гена аденовирус Е1А индуцирует апоптоз в клетках с Р53 дикого типа. Ингибирование активности Р53 с помощью котрансфекции Е1А и Е1В запрещает апоптоз и способствует трансформации. И. наконец, неправильные ДНК-интермедиаты и структуры могут повысить уровень Р53 дикого типа и привести к апоптозу, убирающему поврежденные клетки, или остановке клеточного роста, если ДНК не может быть отрепарирована.
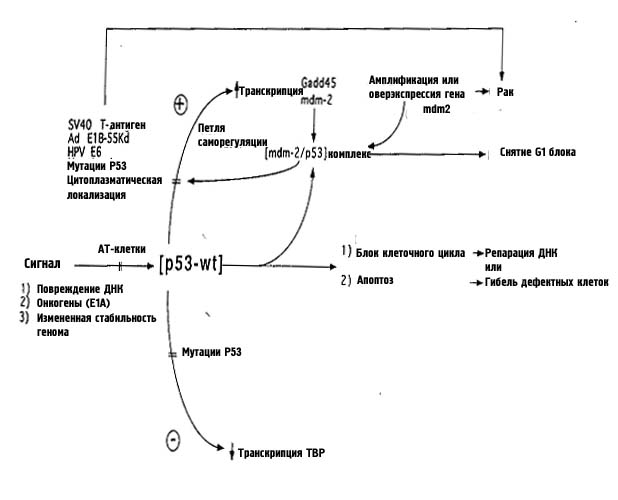
Рисунок 33. Схема работы белка Р53.
Эти механизмы действуют как защитники генома и противостоят преобразованию нормальных клеток в опухолевые. Потеря функции Р53 дикого типа в результате мутаций, образования комплексов с продуктами онкогенных вирусов или с клеточными негативными регуляторами, или изменения его внутриклеточной локализации приводит к утере защитных свойств и способствует развитию онкологических заболеваний. Вероятно, Р53 способен также контролировать RAD51-зависимую гомологичную рекомбинацию, которая может быть одной из причин возникновения хромосомных перестроек в ходе развития опухоли. К настоящему времени сложилось представление, что белки BRCAl, BRCA2 и P53 являются составляющими единого репарационного ядерного комплекса, а различные белок-белковые взаимодействия связаны с регуляцией активности этого комплекса.
Наличие наследственного гетерозиготного носительства мутаций, инактивирующих Р53 приводят к развитию синдрома Ли-Фромени, характеризующегося семейными формами рака различной этиологии.
10.2. Защитники генома. Роль PARP в репарации
Важную роль в регуляции репарации ДНК играют белки семейства PARP – полимеразы поли-АДФ-рибозы. Эти белки, ассоциированные с хроматином способны к модификации многих белков путем их поли-АДФ-рибозилировния. Во время этого процесса PARP использует энергию НАД+ для катализа образования длинных негативно заряженных нитей поли-АДФ-рибозы, линейной или ветвистой структуры, длиной в 200-400 миномеров. Разложение этого полимера происходит под воздействием специальной гликогидролазы (PARG), и приводит к образованию моно-АДФ-рибозилированного белка и моно-АДФ-рибозы. К настоящему времени описаны 6 различных PARP, содержащих консервативный каталитический домен, ответственный за синтез поли-АДФ-рибозы. PARP-1 играет большую роль в репарации ДНК, а роль PARP-2, v PARP, танкиразы 1 и 2, а также Ti PARP досих пор полностью не определена. Кроме участия в регуляции процессов репарации, PARP-1 вносит вклад и в долгожительство млекопитающих. Считается, что она принимает участие в переключении клеточных программ между апоптозом и некрозом. PARP-1 имеет молекулярный вес 113 кД и состоит из трех различных доменов – N-концевой ДНК-связывающий домен с двумя цинковыми пальцами, С-концевой домен, которй содержит каталитическую субъединицу для связывания НАД+, и центральный домен, работающий как акцепторный сайт для поли-АДФ-рибозы. При появлении повреждений ДНК, вызванных ионизирующей радиацией или алкилирующими агентами, PARP-1 специфически связывается с однонитевыми разрывами ДНК, что и приводит к ее авто-поли-АДФ-рибозилировнию и нековалентному взаимодействию с другими белками. PARP-1 и, вероятно, PARP-2 могут быть вовлечены в репарацию ДНК тремя путями, которые изображены на рис. 34 и перечислены ниже:
1. Измененная PARP-1 способна напрямую взаимодействовать с XRCC1 и polβ, играющими ключевую роль в BER. PARP-2 также может связываться с этими белками и лигазой III. При стимуляции in vitro PARP-1 связывается также с нуклеазой FEN-1 и участвует в изменении репарационного синтеза при BER длинными фрагментами. Клетки мышей, дефектных по гену PARP-1 характеризуются повышенной чувствительностью к алкилирующим агентам (например, метил-метан-сульфонату -MMS), сниженным уровнем воссоединения разрывов ДНК и повышенным апоптозом.
2.PARP-1 принимает участие в ремоделировании хроматина под действием повреждений ДНК. Было показано, что автоизмененная PARP-1 взаимодействует с 20S протеасомой через длинный полимер АДФ-рибозы, что повышает протеолитическую активность 20S-протеосомы и активирует ее способность деградировать поврежденные окисленные гистоны, причем самый высокий уровень деградации характерен для гистона Н1 (поврежденный Н1 полностью убирается из хроматина за 30 минут). Деградация гистонов ведет к структурному ремоделированию хроматина, позволяя ферментам, вовлеченным в репарацию ДНК, достичь сайта повреждения.
3. У целого ряда белков, вовлеченных в репарацию ДНК и чекпойнт-ответ на повреждения ДНК, обнаружен специфический мотив для связывания с поли-АДФ-рибозой. Это Р53, Р21, ХРА, MSH6, XRCC1, лигаза III, DNA-PKcs, Ku70, NF-kB, Polε, индуцибельная NO2-синтетаза, активируемая каспазами ДНКаза, теломераза. Полирибозилируя этот мотив, PARP-1 потенциально может влиять на различные функции этих белков, такие как регуляция транскрипции, репарации ДНК, клеточного цикла и апоптоза.
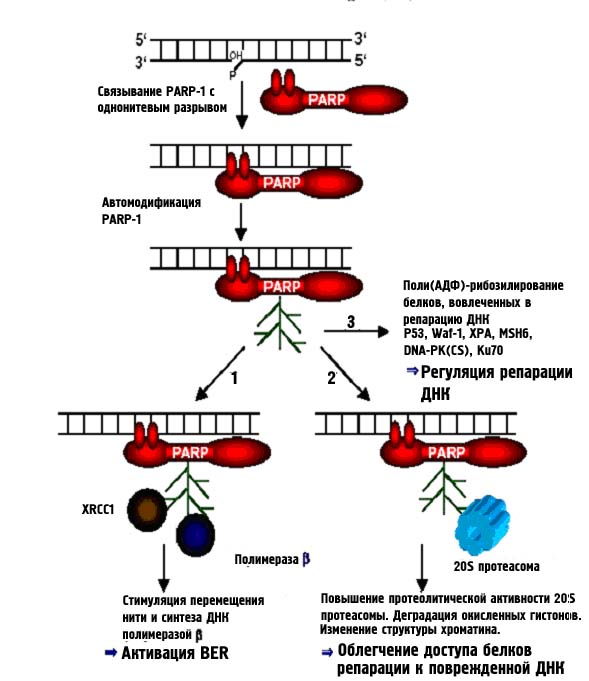
Рисунок 34. Вовлечение в репарацию белков РARP. Пояснения в тексте
Таким образом, роль белков PARP шире, чем просто защита ДНК млекопитающих от рекомбинвации по повторам, о которой мы говорили раньше.
 2015-05-10
2015-05-10 1314
1314
