Временная остановка клеточного цикла в ответ на облучение является одним из первых описанных эффектов радиации. G2-арест в этом контексте рассматривался, как пассивный пороцесс – следствие наличия поврежденной ДНК. Сейчас мы приходим к представлению, что G2-чекпойнт является наиболее активным ответом клетки, играющим серьезную роль в репарации ДНК. Ключевым эффектором этого процесса является необходимая для перехода клетки в митоз CDC2 (CDK1) киназа, активирующаяся при ее ассоциации с циклином B. Это отличие данного чекпойнта от G1 и S-чекпойнтов и утверждение его центральной роли в регуляции клеточного цикла.
Все это подробно показано на рис. 43. G2-арест требует изменения множества регуляторных процессов, вовлеченных в нормальный переход клетки из G2 в М: блокирование киназных функций самой CDC2, отсутствие или перемещение циклина В, а также изменение активности других белков, влияющих на регуляторный комплекс CDC2-циклин В. Основным событием, контролирующим вхождение в митоз, является снятие ингибирующего фосфорилирования с CDC2 по тирозину в 15 положении и триптофану в 14, для чего необходима активная фосфатаза. Таким образом, G2-арест ингибирует это дефосфорилирование, то есть ключевым его событием является регуляция активности фосфатазы CDC25C. Так, активация АТМ приводит к активации СНК2 через фосфорилирование триптофана в 68 положении. Активная CHK2 в свою очередь фосфорилирует CDC25C по серину в 215 положении, что приводит к блокированию ее функций. Фосфорилированная форма фосфатазы CDC25C связывается с белком 14-3-3σ, что поддерживает ее каталитическую неактивность и способствует переходу в цитоплазму и секвестрированию. Вторая ветвь G2-чекпойнта опосредуется через ATR/CHK1 активацию. При этом пути одновременно фосфорилируется-выключается белок CDC25А, а также фосфорилируется серин-549 белка Wee1, что облегчает его связывание тем же белком 14-3-3σ и приводит к усилению ингибиторной активности киназ по отношению к CDC2. Это придает второй ветви большую гибкость в контроле и консолидации G2-ареста.
Сами пореждения ДНК тоже могут регулировать активность CDC2 через циклин В. В некоторых клеточных линиях после облучения резко падает уровень мРНК циклина В, возможно из-за ее повышенной нестабильности, причем этот эффект определяет протяженность G2-ареста.
Также нужно иметь ввиду, что циклин В во время G1 и S фаз имеет цитоплазматическую локализацию и перемещается в ядро только к началу митоза. Также есть данные, что белок 14-3-3σ приводит к секвевтрированию циклина В в цитоплазме в ответ на повреждение ДНК.
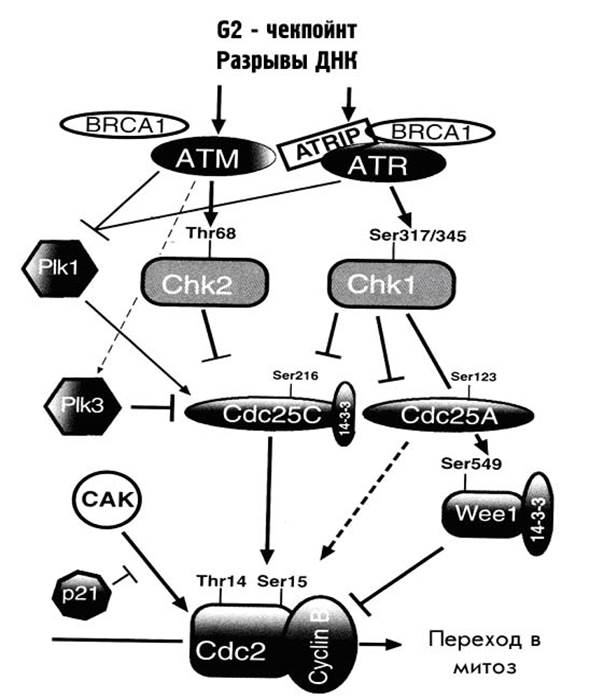
Рисунок 43. Схема G2-чекпойнта, возникающего в ответ на повреждение ДНК.
Недавно были описаны еще два белка – регулятора CDC25C, принимающих участие в G2-чекпойнте, названные PLK1 и PLK3 (Polo-like kinase). Белки этого семейства принимают активное участие в митозе, включая вход и выход из него. У них всех есть крайне консервативный карбоксильный домен, имеющий два блока очень высокой гомологии, названные поло-боксами. PLK1 является позитивным регулятором CDC25C-активности в необлученных клетках и, специфически фосфорелируя ее, способствует вхождению в митоз. PLK3, напротив, активируется АТМ в ответ на повреждение ДНК, взаимодействует с CDC25C, фосфорелируя ее по серину-216, что приводит к ингибировангию ее активности Еще одной возможностью остановить вход в митоз при наличии повреждений в ДНК является взаимодействие белка PCNA c Р21, CDC25C и комплексом CDC2-циклин В, но не одновременное, а последовательное. Показано, что связывание Р21 и CDC25C с комплексом PCNA-CDC2-циклин В является совершенно особым и не позволяет CDC25C дефосфорелировать CDC2 для активации митоза. В дополнение к этому, Р21 может блокировать особую киназу САК (CDКs activating kinase), которая активирует CDC2 путем фосфорелирования триптофана в 161 положении. Участие Р21 в G2-ответе указывает на то, что в нем участвует и Р53. Роль Р53 в поддержании G2-ареста состоит в том, что он активирует транскрипцию трех вовлеченных в него белков: GADD45. P21 и 14-3-3σ и подавляет транскрипцию CDC2 и циклина В.
И, наконец, есть данные о вовлеченности в G2-арест BRCA1, опосредованно через ATM/ATR или напрямую, через активацию CHK1, но механизм этого остается неясным.
Таким образом, к настоящему времени стало ясно, что G2-реакция клетки на облучение зависит от фазы цикла, в которую это произошло. Одновременно становится понятным, что G2 чекпойнт-ответ разделяется на два молекулярно различных пути. Один начинается сразу же после облучения, захватывает клетки, облученные непосредственно в G2-фазе и является АТМ-зависимым, проходящим и независимым от дозы. Он приводит к резкому снижению митотического индекса. Второй, который развивается позже, в клетках, облученных на более ранних стадиях клеточного цикла, является АТМ-независимым, зато зависимым от дозы и приводит к накоплению клеток в фазе G2.
15.4. Чекпойнты, вызванные повреждениями ДНК и репарация двунитевых разрывов.
Широко распространенное мнение о том, что чекпойнты способствуют репарации ДНК кажется очевидным, но это никогда не было строго доказано. Представляется ясным, что чекпойнт – это не только «период ожидания» внутри клеточного цикла. Для того, чтобы оценить репарацию потенциально летальных повреждений, были использованы различные экспериментальные подходы, затрагивающие время задержек в клеточном цикле. Рассматривая чекпойнты, вызванные повреждением ДНК, и процессы репарации ДНК, можно попытаться объединить их с основными событиями нормального клеточного цикла. Дискуссия обычно ведется вокруг двунитевых разрывов ДНК и их репарации, но может быть распространена и на другие типы ДНК-повреждений. То есть, регулируемые переходы из фазы в фазу клеточного цикла, связанные с чекпойнтами, должны приводить ДНК в состояние, удобное для репарации двунитевых разрывов. Двунитевые разрывы ДНК могут индуцироваться во всех фазах клеточного цикла, но их репарация оптимально происходит только в некоторых, так как на них могут накладываться изменения хроматина, связанные с прохождением клеточного цикла. Таким образом чекпойнт-ответ может быть полезен в нескольких направлениях: (1) оставить время для репарации в тех фазах клеточного цикла, в которых двунитевые разрывы ДНК образовались; (2) позволить частичный процессинг повреждений и допустить переход в следующую фазу, в которой эти повреждения ДНК будут оптимально репарированы; (3) препятствовать угрожающему изменению конформации хроматина, которое может усложнить правильную репарацию.
Нужно напомнить, что репарация двунитевых разрывов в основном (1:1500) происходит путем негомологического воссоединения концов, и лишь небольшая часть DSBs удаляется из генома крайне важным для понимания радиочувствительности клеток методом гомологической рекомбинации. Негомологическое воссоединение концов – процесс быстрый, 75% разрывов зашиваются в течение первых 20 минут, к тому же этот процесс активен во всех фазах клеточного цикла, включая S-фазу. Неприятно, но очевидно, что этот процесс нельзя рассматривать как зависимый от чекпойнт-ответа на повреждения, так как сам чекпойнт-ответ достигает максимума только через 1-2 часа. Итак, репарация двунитевых разрывов путем негомологического воссоединения концов является чекпойнт-независимым процессом.
С другой стороны, накоплено много данных, подтверждающих зависимость от чекпойнт-ответа репарации путем гомологической рекомбинации. В ней участвуют многие белки, вовлеченные в чекпойнт-ответ, к тому же медленное протекание этого процесса соответствует времени чекпойнт-ответа.
В настоящее время предложена модель-идея, что негомологическое воссоединение концов – это только первый шаг процесса репарации двунитевых разрывов, цель которого просто сохранить целостность генома, несмотря на низкую точность. За ним следует процесс гомологической рекомбинации, цель которого восстановить, так как это принципиально важно, точную последовательность нуклеотидов вокруг разрыва. Эта вторая фаза репарации таким же образом может восстанавливать точность всех репарационных процессов. По этой (весьма спекулятивной) теории, репарация двунитевых разрывов ДНК – процесс многоступенчатый, начинающийся с синапсиса концов и завершающийся восстановлением точной последовательности ДНК. Быстрый начальный шаг NHEJ крайне чувствителен к изменениям конформации хроматина, которые происходят при вхождении клетки в S-фазу и в митоз, и могут приводить к разделению концов, усложняя их правильное воссоединение. Последующие шаги чекпойнт-ответа, кажется, более тесно связаны с дальнейшими ступенями репарации и могут приводить ДНК в состояние, при котором репарация путем гомологической рекомбинации будет идти более эффективно. В тоже время они могут блокировать биохимические процессы, связанные с репликацией ДНК и делением.
 2015-05-10
2015-05-10 967
967








