Министерство образования Российской Федерации
Владимирский государственный университет
Кафедра физики и прикладной математики
К ЛАБОРАТОРНЫМ РАБОТАМ ПО ФИЗИКЕ
Физика твёрдого тела
Составители
Прокошева Н.С.
Прокошев В.Г.
Скоробогатова Т.В.
Абрамов Д.В.
Шишин С.И.
Григорьева Е.В.
Владимир 2003
Методические указания к лабораторным работам по физике. Физика твердого тела / Владимирский государственный университет: Сост.: Н.С. Прокошева, В.Г. Прокошев, Т.В. Скоробогатова, Д.В. Абрамов, С.И. Шишин, Е.В. Григорьева. Владимир. 2003. 44с.
Издание предназначено для студентов всех специальностей и видов обучения, изучающих раздел «Физика твердого тела» в курсе общей физики.
Ил. 21. Библиогр.: 4 назв.
Рецензент – доктор физ.-мат. наук, профессор Потехин К.А., Владимирский государственный педагогический университет.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К ЛАБОРАТОРНЫМ РАБОТАМ ПО ФИЗИКЕ
Физика твердого тела.
Под редакцией Прокошевой Н.С.
Составители:
Прокошева Надежда Сергеевна
Прокошев Валерий Григорьевич
Скоробогатова Татьяна Васильевна
Абрамов Дмитрий Владимирович
Шишин Сергей Иванович
Григорьева Елена Всеволодовна
ЭЛЕМЕНТЫ ЗОННОЙ ТЕОРИИ ТВЕРДЫХ ТЕЛ.
I. НЕКОТОРЫЕ СВЕДЕНИЯ ИЗ КВАНТОВОЙ МЕХАНИКИ.
Отличительной особенностью микросистем (атомов, молекул, ионов) является то, что среди бесконечного множества состояний, в которых они могут находиться, наблюдаются такие состояния, между которыми невозможны непрерывные переходы. Переходы осуществляются не через множество промежуточных состояний, а "скачкообразно". При таких переходах характеристики состояний (энергия, импульс, механический и магнитный моменты и др.) изменяются скачкообразно, т.е. имеют ряд дискретных значений − квантуются. Целые или полуцелые числа, определяющие значения квантующихся величин, называются квантовыми числами.
Для характеристики состояния микрочастицы в атоме введены четыре квантовых числа: три (n,l,m - главное, орбитальное и магнитное) соответствуют степеням свободы микрочастицы при ее перемещении в пространстве, четвертое квантовое число (s) не связано с пространственными перемещениями частицы и описывает собственный механический и магнитный моменты, которыми может обладать частица.
Например, полная энергия электрона в атоме водорода, получаемая как результат решения уравнения Шредингера для атома водорода, равна
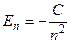 , (1)
, (1)
где С - постоянная величина, n - главное квантовое число, которое может принимать значения 1,2,3...и т.д.
Квантовое число l - характеризует орбитальные механические и магнитные моменты электрона, m - их проекции на фиксированную ось.
Электрон в изолированном атоме может иметь только дискретные значения энергии, называемые энергетическими уровнями (эти значения зависят от строения атома), промежуточные значения энергии запрещены.
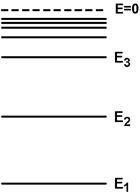 Изолированный атом характеризуется серией энергетических уровней. У каждого элемента имеется характерная для него совокупность уровней − энергетический спектр (рис.1). Заполнение уровней электронами определяется принципом минимума энергии и принципом Паули. При Т= 0 К "заполняются" уровни с наименьшей энергией (принцип минимума энергии). На одном уровне не может находиться более двух электронов с одинаковыми квантовыми числами n,l,m (принцип Паули).
Изолированный атом характеризуется серией энергетических уровней. У каждого элемента имеется характерная для него совокупность уровней − энергетический спектр (рис.1). Заполнение уровней электронами определяется принципом минимума энергии и принципом Паули. При Т= 0 К "заполняются" уровни с наименьшей энергией (принцип минимума энергии). На одном уровне не может находиться более двух электронов с одинаковыми квантовыми числами n,l,m (принцип Паули).
Совокупность уровней атома с распределенными по ним электронами называют электронным состоянием или электронной конфигурацией. Состояния с одинаковыми энергиями называют вырожденными, а Рис.1. число состояний с одинаковыми энергиями называют кратностью вырождения.
 2015-05-13
2015-05-13 953
953







