Для заряда аккумулятор подключают к источнику постоянного тока (генератору, выпрямителю) так, чтобы "плюс" аккумулятора был соединен с положительным полюсом источника, а "минус" аккумулятора - с отрицательным.
Напряжение источника поддерживается большим, чем ЭДС аккумулятора, поэтому через аккумулятор проходит постоянный ток, направленный противоположно разрядному току. При этом электрическая энергия, отдаваемая источником, запасается в аккумуляторе в виде химической энергии. Образовавшийся на положительном и отрицательном электродах в процессе разряда сульфат свинца при заряде переходит в электролит (рис. 6.15) и распадается на ионы Рb+2 и S04-2:
PbSO4-->Pb+2+SO4-2. (6.24)
Вода Н20 диссоциирует на ионы водорода Н+ и ионы гидрооксидной группы ОН-:
Н2ОàН++OH-. (6.25)
При прохождении электрического тока ионы свинца РЬ+2 на положительном электроде окисляются до четырехвалентного свинца РЬ+4, отдавая по два электрона во внешнюю цепь:
Pb+2 àPb+4 +2e (6.26)
Ионы Рb+4 соединяются с ионами гидрооксидной группы ОН-, полученными при диссоциации воды, и образуют молекулу окиси свинца:
Рb+4 + 4OH - èPb(OH)4 (6.27)
Pb(OH)4àPbO2 + 2H2O. (6.28)
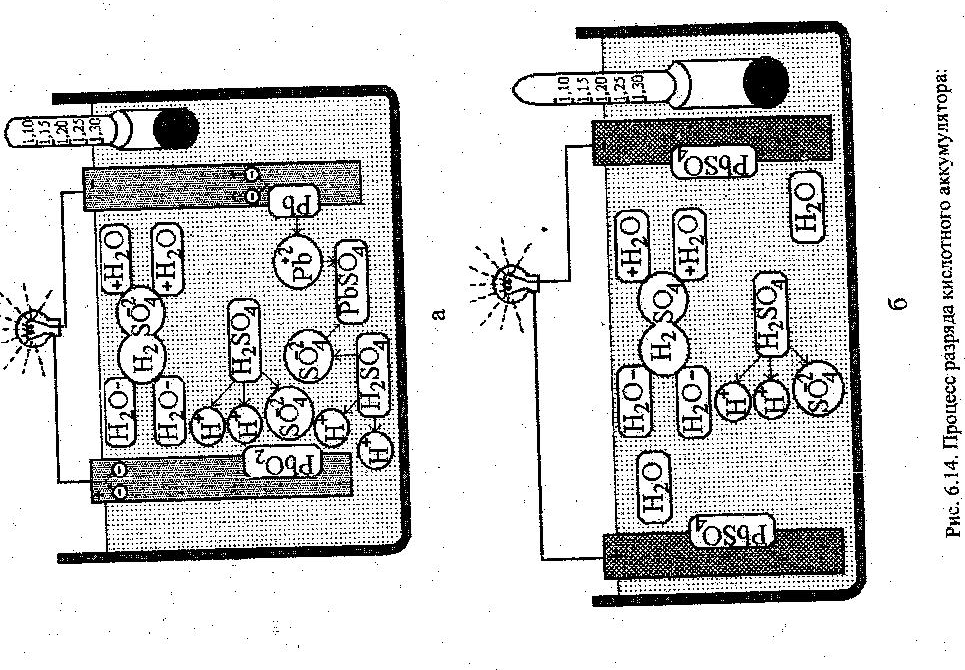
В результате взаимодействия ионов водорода H+ с ионами кислотного остатка SO4-2 образуется молекула серной кислоты:
2Н+ + SO4-2 à H2SO4. (6.29)
Электрохимическая реакция у положительного электрода протекает в соответствии с уравнением:
PbSO4-2e+2H2OàPbO2 + H2SO4+2H+. (6.30)
На отрицательном электроде ионы свинца РЬ+2 получают из внешней цепи по два электрона и восстанавливаются до губчатого свинца:
Pb+2 +2eà Рb
а ионы водорода Н+, соединяясь с ионами SO4-2, также образуют молекулу серной кислоты:
2H++ SO4-2àH2 SO4. (6.32)
Электрохимическая реакция у отрицательного электрода протекает по выражению
PbS04+ 2е+ 2H+ àPb + Н2 SO4. (6.33)
В целом электрохимический процесс заряда свинцово-кислотного аккумулятора описывается уравнением
PbSO4 + 2Н2О+ PbSO4 àPbO2 + 2H2 SO4+ Pb. (6.34).
Таким образом, при заряде сульфат свинца на положительном электроде восстанавливается в двуокись свинца, а на отрицательном - в свинец. Получающаяся после заряда электрохимическая система имеет вид
| + | электролит | - |
| Рb02 | H2SO4 | Pb |
Она является системой заряженного аккумулятора.
Если сравнить реакции (6.23) и (6.34), то нетрудно увидеть, что электрохимическая система свинцово-кислотного аккумулятора обратима. Обратимость ее выражается уравнением
РbO2 + 2Н2 SO4+PbзарядàPbSO4 + 2H2O + PbSO4. (6.35)
При заряде свинцово-кислотного аккумулятора количество воды в электролите уменьшается, а кислоты увеличивается. Это приводит к повышению плотности электролита. Плотность электролита повышается до тех пор, пока весь сульфат свинца не преобразуется в активное вещество. Повышение плотности электролита до того значения, которое было перед разрядом, является одним из основных признаков конца заряда.
 2015-05-13
2015-05-13 1640
1640
