Электрохимические процессы при разряде аккумулятора. Атомы молекулы воды связаны между собой во много раз прочнее, чем ионы молекул серной кислоты, поэтому в процессе приготовления кислотного электролита вода не разлагается, а серная кислота H2SO4) находящаяся в: электролите, диссоциирует на положительные Н+ и отрицательные 804- ионы (рис. 6.14)
H2SO4-à2H+ + SO4 -2
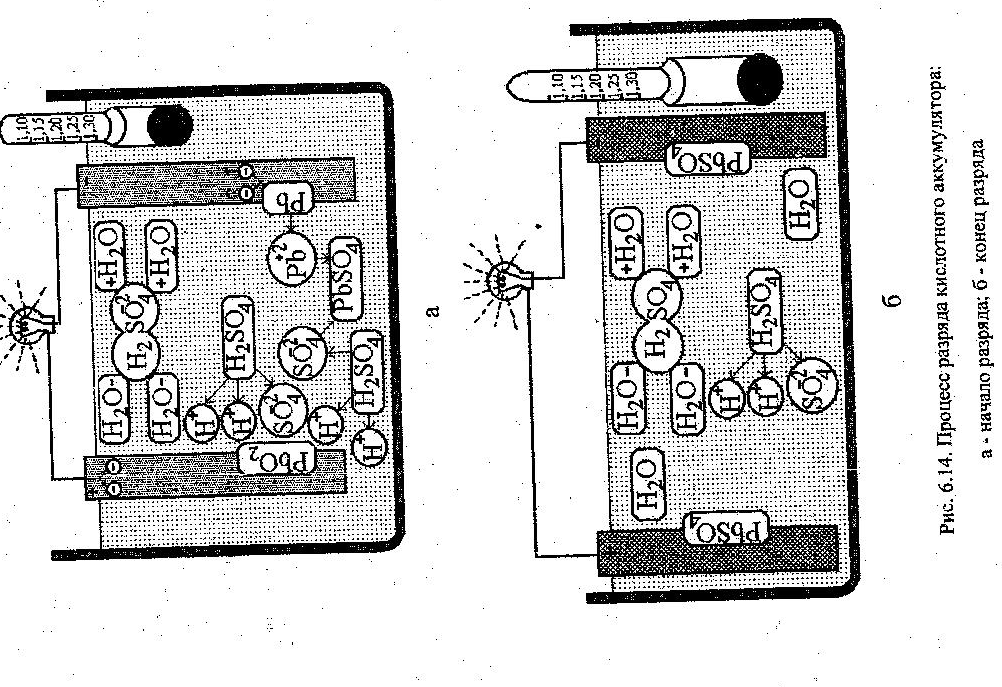
В результате электролитической диссоциации в электролите образуются ионы 2Н+ и SO4 -2.
На положительном электроде двуокись свинца РЬО2, растворяясь в электролите, образует с водой Н2О химическое соединение РЬ(ОН)4 - гидрат окиси свинца:
РЬО2 + 2Н2ОàРb(ОН)4. (6.14)
Молекула Рb(ОН) 4 в электролите распадается на четырехвалентный ион свинца и четыре одновалентных иона гидрооксидной группы:
Pb(OH)4 à Pb +4 + 4OH- (6.15)
Ионы Рb переходят на поверхность электрода, сообщая ему положительный заряд, а отрицательные ионы гидрооксидной группы 4ОН- остаются в электролите.
Поэтому РЬО2 в растворе H2SO4 обладает высоким положительным потенциалом и используется в качестве активной массы положительного электрода аккумулятора.
Таким образом, на границе между положительным электродом и электролитом образуется двойной электрический слой, в результате чего электрод заряжается положительно, априлегающий к нему слой электролита - отрицательно.
На отрицательном электроде свинец РЬ, частично растворяясь в электролите, выделяет в раствор положительные ионы РЬ+2, врезультате чего прилегающий слой электролита заряжается положительно:
Рb àРb+2 +2е- (6.16)
На самом электроде остаются избыточные электроны 2е-, которые и сообщают ему отрицательный заряд.
Если замкнуть внешнюю цепь, то под действием ЭДС аккумулятора по цепи потечет электрический ток - начнется движение электронов с отрицательного на положительный электрод (рис. 6.14а).
Каждые два электрона 2е-, поступившие с отрицательного электрода, будут восстанавливать на поверхности положительного электрода четырехвалентный свинец РЬ до двухвалентного
Рb+4 +2e-àРЬ+2, (6.17)
который переходит в электролит и соединяется с SO4-2, образуя молекулу сульфата свинца PbSO4:
Pb+2+ SO4-2à PbSO4 (6.18)
Сульфат свинца PbSO4, обладая очень малой растворимостью в электролите, осаждается на поверхности положительного электрода. Ионы гидрооксидной группы 4ОН-, взаимодействуя с 4Н+ (продуктами диссоциации серной кислоты), образуют воду:
Следовательно, под дейст ванные молекулы к
4H++ 4OH -à4Н2О.. (6.19)
Следовательно, под действием разрядного тока на каждые две израсходованные молекулы Н2SO4 и две молекулы H2O вновь образуется четыре молекулы воды.
Значит, плотность электролита в процессе разряда кислотного аккумулятора будет постоянно понижаться (рис. 6.14б).
Электрохимическая реакция на положительном электроде будет иметь вид:
РbО2. + 2е -+2Н+ + Н2 SO4 à PbSO4 +2H2O. (6.20)
По мере перетока электронов во внешнюю цепь на отрицательном.электроде двухвалентные ионы свинца РЬ +2находящиеся в электролите, взаимодействуют с ионами кислотного остатка SO4-2, образуя PbSO4, который будет осаждаться на поверхности отрицательного электрода:
Pb+2+SO4-2àPbSO4. (6.21)
Электрохимическая реакция у отрицательного электрода имеет
Pb+ SO4 -2àPbSO4+2e. (6.22)
В целом электрохимический процесс разряда кислотного аккумулятора описывается уравнением:
РbО2 + 2Н2 S04 +Pb à PbS04 + 2H2O+PbSO4. (6.23)
Таким образом, при разряде, активные вещества обоих электродов превращаются в сульфат свинца. Возникающая после разряда электрохимическая система имеет вид:
| + | электролит | - |
| PbSO4 | Н2О | PbSO4 |
Эта система не может быть химическим источником тока, поскольку оба электрода содержат одно и то же активное вещество.
 2015-05-13
2015-05-13 1026
1026








