Серная кислота и растворимые сульфаты с катионами Ва2+, Sr2+, Ca2+ образуют осадки сульфатов белого цвета:
Ba2+ + SO42– → BaSO4↓,
Sr2+ + SO42– → SrSO4↓,
Ca2+ + SO42– → CaSO4↓.
Ввиду сравнительно большой растворимости CaSO4 ион Са2+ разбавленным раствором H2SO4 полностью осадить нельзя. Его осаждают при действии концентрированного или спиртового раствора H2SO4.
Сульфаты катионов второй группы нерастворимы в кислотах и щелочах. Поэтому для получения в растворе свободных ионов Ва2+, Sr2+, Ca2+ сульфаты переводят в карбонаты, а последние растворяют в уксусной кислоте. Например:
BaSO4 + CO32– → ВаСО3↓ + SO42–,
ВаСО3 + 2СН3СООН →Ва2++ 2СН3СОО– + CO2 + Н2О.
Однако CaSO4, в отличие от SrSO4, растворим в насыщенном растворе (NH4)2SO4 вследствие образования растворимого комплекса CaSO4:
Са2+ + SO42– →CaSO4↓.
Эту реакцию используют для разделения катионов Са2+ и Sr2+.
Выполнение реакций:
а. В три пробирки поместить по 2–3 капли растворов ВаС12, SrCl2, СаС12, прибавить в каждую пробирку 1–2 капли 1 Мраствора H2SO4, перемешать. Убедиться, что осадок CaSO4 не выпал. Прибавить в пробирку с раствором СаС12 2 капли этанола, перемешать, наблюдать осаждение CaSO4. Получить осадок CaSO4, прибавив к 2–3 каплям раствора СаС12 1–2 капли концентрированного раствора H2SO4. Осадки BaSO4 и SrSO4 разделить на две части, осадок CaSO4 – на три части. Исследовать растворимость сульфатов в кислотах, щелочах и растворимость CaSO4 в насыщенном растворе (NH4)2SO4 при нагревании.
б. В пробирки поместить по 3 капли растворов ВаС12, SrCl2, СаС12, прибавить 5 капель этанола и 9–10 капель 1 Мраствора H2SO4, перемешать. Осадок отцентрифугировать и промыть дистиллированной водой. К промытому осадку сульфатов прибавить 2 мл 5 М раствора Na2СО3, взмутить осадок и перенести смесь в фарфоровую чашечку. Кипятить 4–5 мин, после охлаждения добавить 1–2 мл дистиллированной воды, перемешать, дать отстояться и слить прозрачный слой жидкости, содержащий ион SO42–. Осадок вновь обработать раствором Na2СО3, повторив все операции и заменив сливание раствора сульфата центрифугированием. Осадок промыть дистиллированной водой 2–3 раза до полного удаления ионов SO42– и растворить, добавляя по каплям и при перемешивании 2 Мраствор СНзСООН.
Условие проведения реакции. Осаждение сульфатов 1 Мраствором H2SO4 проводят в присутствии этанола.
Частные аналитические реакции ионов Ba2+
1.3.1. Хромат калия К2СrO4 и дихромат калия К2Сr2О7 дают с ионами Ва2+ желтый кристаллический осадок ВаСrО4:
Ва2+ + СrО42– →ВаСrО4↓,
2BaCl2 + K2Cr2O7 + H2O → 2BaCrO4↓ + 2КС1 + 2НС1,
2Ва2 + + Сr2О72–+ Н2О → 2BaCrO4 ↓ + 2Н+.
Осадок ВаСrО4 не растворяется в СН3СООН, но растворяется в сильных кислотах HNO3, HC1. Осаждение ионов Ва2+ раствором К2Сr2О7 не идет до конца вследствие частичного растворения ВаСrО4 в сильной кислоте, которая образуется в результате реакции (см. уравнение). При добавлении CH3COONa сильная кислота замещается на слабую СНзСООН, в которой ВаСrО4 не растворяется.
Н+ + СН3СОО– →СН3СООН.
При этом образуется буферная смесь (СН3СООН + CH3COONa) с рН = 4 – 5, обеспечивающая полноту осаждения ВаСrО4. В отличие от ВаСrО4 (KS0 = 1,2 ∙10–10) осадок SrCrO4 (KS0 = 3,6∙10–5) растворяется в СН3СООН, поэтому не может быть осажден при данном значении рН. Осадок СаСrО4 (KS0 = 7,1·10–4), являясь наиболее растворимым, также не осаждается при данных условиях. Следовательно, эта реакция может быть использована как для обнаружения иона Ва2+ в присутствии ионов Са2+ и Sr2+, так и для отделения иона Ва2+ от этих ионов.
Выполнение реакций. К 2–3 каплям ВаС12 прибавить 1–2 капли раствора К2СгO4. Полученный осадок разделить на две части и исследовать его растворимость в НС1 или HNO3 и в СН3СООН, прибавив к осадку по 3–4 капли 2 Мраствора кислоты. В другую пробирку поместить 2–3 капли раствора ВаС12, прибавить 4–5 капель раствора К2Сr2О7 и 2–3 капли раствора CH3COONa.
Условия проведения реакции – слабокислая среда, при наличии ацетатного буферного раствора. Реакции мешает присутствие катионов Рb2+.
1.3.2. Родизонат натрия Na2С6О6 с ионами бария образует красно-бурый осадок родизоната бария ВаС6О6, который при действии НС1 становится розово-красным вследствие превращения в гидрородизонат бария:
Выполнение реакции. На фильтровальную бумагу нанести каплю раствора ВаС12 и каплю реактива. На красно-бурое пятно образовавшегося осадка подействовать каплей 0,5 Мраствора НС1. Наблюдать изменение окраски осадка.
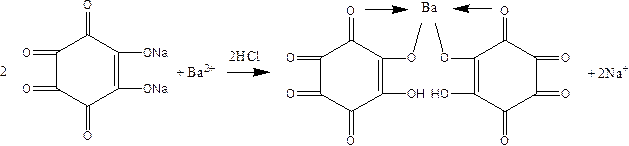
1.3.3. Реакция окрашивания пламени. Летучие cоли бария окрашивают бесцветное пламя в зеленый цвет.
Частные аналитические реакции ионов Sr2+
1.3.4. Гипсовая вода (насыщенный раствор гипса CaSO4∙2H2O) с катионами Sr2+ образует осадок (муть) SrSO4:
Sr2+ + CaSO4 → SrSO4↓ + Ca2+.
Появление мути SrSO4 объясняется малой концентрацией ионов SO42– в гипсовой воде за счет незначительной растворимости CaSO4.
Выполнение реакции. К 2–3 каплям SrCl2 прибавить 3–4 капли гипсовой воды, нагреть при перемешивании до появления белой мути.
Условия проведения реакции – в отсутствие ионов Ва2+. Ионы Ва2+ с гипсовой водой дают осадок BaSO4, который образуется лучше, чем SrSO4 (KS0(BaSO4) < KS0(SrSO4))
1.3.5. Родизонат натрия Na2C6O6 с ионами Sr2+ в нейтральной среде дает красно-бурый осадок SrC6O6, растворимый в НС1:
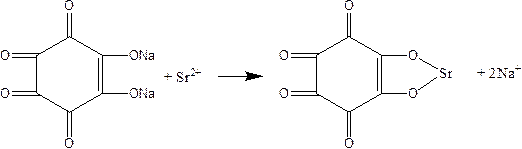
Выполнение реакции. На фильтровальную бумагу нанести каплю раствора SrCl2 и каплю реактива. На красно-бурое пятно осадка подействовать каплей раствора НС1. Наблюдать обесцвечивание.
1.3.6. Реакция окрашивания пламени. Летучие соли стронция окрашивают бесцветное пламя в карминно-красный цвет.
Частные аналитические реакции ионов Са2+
1.3.7. Оксалат аммония (NH4)2C2O4 и другие растворимые соли щавелевой кислоты образуют с катионом Са2+ белый кристаллический осадок СаС2О4:
Са2+ + С2О42– → СаС2О4↓.
Осадок растворим в сильных кислотах НС1 и HNO3:
СаС2О4 + 2Н+ → Са2+ + Н2С2О4,
но не растворяется в СНзСООН.
Выполнение реакций. К 2– 3 каплям раствора СаС12 прибавить 1–2 капли раствора (NH4)2C2O4. Осадок разделить на две части и исследовать его растворимость в НС1 иСН3СООН.
Условия проведения реакции – в нейтральной или слабокислой среде в отсутствие катионов Ва2+ и Sr2+.
1.3.8. Открытие Ca2+ с помощью индикатора хрома темно-синего.
В присутствии аммонийной буферной смеси (рН = 9,2) раствор, содержащий ионы кальция, при добавлении хрома темно-синего окрашивается в малиновый или вишневый цвет. Реакции мешают металлы, дающие комплексные соединения с кислотным хромом темно-синим.
1.3.9. Реакция окрашивания пламени. Соли кальция окрашивают бесцветное пламя в кирпично-красный цвет.
1.3.10. Важное значение в анализе имеют также реакции катионов II аналитической группы с карбонатом аммония, оксалатом аммония, гидрофосфатом натрия.
Контрольные вопросы
1. Какова сравнительная растворимость сульфатов катионов II группы?
2. Как понизить растворимость сульфата кальция CaSO4?
3. Как переводят в раствор сульфаты II группы?
4. В чем растворяют карбонаты катионов II группы?
5. С помощью какого реактива открывают Ва2+ в присутствии Sr2+ и Са2+?
6. Каковы условия практически полного осаждения ВаСrО4 при действии дихромата калия?
7. Почему необходимо удалить катион Ва2+ перед обнаружением Sr2+ и Са2+?
8. Почему при действии «гипсовой воды» на катион Sr2+ образуется не осадок, а лишь «муть» SrSO4?
9. Для чего при осаждении сульфатов добавляют этанол?
 2015-05-13
2015-05-13 6982
6982
