При взаимодействии катионов III группы с гидроксидами натрия или калия образуются осадки соответствующих гидроксидов:
А13+ + 3ОН– → А1(OН)3↓,
Cr3+ + 3ОН– → Cr(OH)3↓,
Zn2+ + 2ОН– → Zn(OH)2↓,
Sn2+ + 2ОН– → Sn(OH)2↓,
Sn4+ + 4ОН– → Sn(OH)4↓.
Гидроксиды растворяются в избытке щелочи
А1(ОН)3 + ОН– → A1O2– + 2H2O,
Сr(ОН)3 + ОН– → CrO2– + 2Н2О,
Zn(OH)2 + 2ОН– →ZnO22– +2H2O,
Sn(OH)2 + 2ОН– → SnO22–+2H2O,
Sn(OH)4 + 2ОН– → SnO32– +2H2O
и в кислотах:
А1(ОН)3 + 3Н+ → А13+ + 3Н2О,
Сr(ОН)3 + 3Н+ → Сr3+ + 3Н2О,
Zn(OH)2 + 2Н+ → Zn2+ + 2Н2О,
Sn(OH)2 + 2Н+ → Sn2+ + 2Н2О,
Sn(OH)4 + 4H+ → Sn4+ + 4H2O.
Гидроксид хрома Сr(ОН)3 не растворяется в избытке щелочи в присутствии ионов Zn2+ вследствие образования цинката хрома Cr2(ZnO2)3. Этого удается избежать, если гидроксид хрома растворяют в избытке щелочи в присутствии Н2О2, при этом образуются СrO42– -ионы.
При кипячении CrO2– гидролизуется с образованием осадка Сr(ОН)3:
СгО2– + 2Н2О → Сr(ОН)3↓ + ОН–.
Выполнение реакций. В пять пробирок поместить по 3–4 капли солей алюминия, цинка, хрома, олова (II)и олова (IV). Добавить в каждую пробирку 1–2 капли 2 Мраствора NaOH. Отметить цвет и характер каждого осадка. Образовавшиеся осадки разделить на две части и исследовать их растворимость в избытке щелочи и в НС1. Раствор хромита разбавить водой и нагреть на водяной бане до выпадения осадка Сr(ОН)3. К растворам алюмината и станната прибавить кристаллический NH4C1 или несколько капель насыщенного раствора NH4C1, нагреть до образования осадков А1(ОН)3 и Sn(OH)4. В отдельную пробирку поместить 3 капли раствора соли хрома и 3 капли раствора соли цинка, перемешать, добавить 10 капель 2 Мраствора NaOH, убедиться, что осадок не растворяется в избытке щелочи.
|
|
|
Частные аналитические реакции ионов Al3+
1.4.1. Ализарин (1,2-диоксиантрахинон) С14Н6О2(ОН)2 образует с гидроксидом алюминия малорастворимое внутрикомплексное соединение ярко-красного цвета – «алюминиевый лак»:
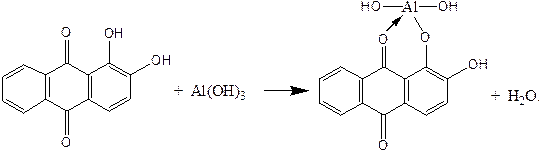
Выполнению реакции мешает присутствие гидроксидов Zn(OH)2, Сr(ОН)3, Sn(OH)2, которые с ализарином также дают окрашенные «лаки». В ходе анализа смеси катионов III группы ион цинка (II) образует комплекс Zn(NH3)42+, а ион хрома (III)окисляется до СrО42–, поэтому обнаружению А13+ не мешают. Другие мешающие ионы можно предварительно связать действием K4[Fe(CN)6] в труднорастворимый комплекс (капельный метод). Предел обнаружения реакции 0,5 мкг.
Выполнение реакций:
а. В пробирку поместить 2–3 капли раствора соли алюминия и несколько капель 2 Мраствора NH4OH до образования осадка А1(ОН)3. Нагреть и добавить 3–4 капли раствора ализарина. Осадок А1(ОН)3 окрашивается в ярко-красный цвет.
б. Эту реакцию можно выполнять капельным методом. На полоску фильтровальной бумаги нанести каплю раствора соли алюминия. Когда раствор впитается в бумагу, подержать полоску над открытой склянкой с концентрированным раствором аммиака. На влажное пятно нанести каплю ализарина и вновь обработать его парами аммиака. Подсушить пятно до перехода фиолетовой окраски ализарина в желтую, на фоне которой наблюдается ало-красное пятно «алюминиевого лака».
|
|
|
1.4.2. Алюминон (аммонийная соль ауринтрикарбоновой кислоты) с гидроксидом алюминия образует красные хлопья «алюминиевого лака».
Реакция протекает медленно. Ее проведению мешает присутствие катионов Cr3+, Fe3+, Ca2+, которые дают аналогичный «лак», разрушаемый при действии NH4OH или (NH4)2CO3.
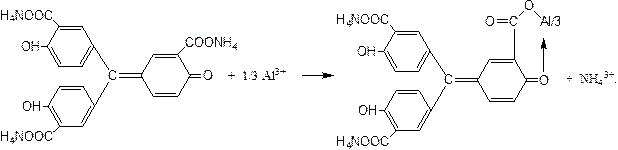 Выполнение реакций. К 2 каплям раствора соли алюминия, подкисленного уксусной кислотой, прибавить 1–2 капли 0,01 % раствора алюминона, нагреть на водяной бане и прибавить раствор NH4OH до появления запаха аммиака и 2–3 капли раствора (NH4)2CO3.
Выполнение реакций. К 2 каплям раствора соли алюминия, подкисленного уксусной кислотой, прибавить 1–2 капли 0,01 % раствора алюминона, нагреть на водяной бане и прибавить раствор NH4OH до появления запаха аммиака и 2–3 капли раствора (NH4)2CO3.
1.4.3 Важное значение в анализе имеют также реакции с ацететом натрия, гидрофосфатом натрия, сульфидом аммония.
Частные аналитические реакции ионов Cr3+
1.4.4. Окисление иона Cr3+ в кислой среде действием персульфата аммония (NH4)2S2O8 (в присутствии катализатора AgNO3) позволяет получить ион Сr2О72–, который имеет желто-оранжевую окраску.
Cr(NO3)3 + 3(NH4)2S2O8 + 7H2O → H2Сr2О7 +6H2SO4 + 6NH4NO3.
В пробирку помещают раствор, содержащий ионы Cr3+, 5 капель 2М H2SO4, небольшое количество персульфата аммония (сухого) и 1-2 капли AgNO3. Раствор нагревают до кипения. Появление желтой окраски указывает на присутствие ионов Cr3+.
1.4.5. Образование перекиси хрома CrO5.
При действии Н2О2 на подкисленный раствор дихромат-иона образуется пероксокислота (надхромовая) синего цвета:
Сr2О72– + 4Н2О2 + 2Н+ → 2СrO5 + 3Н2О.
Перекись хрома легко разлагается в водном растворе до Сr3+ иО2, поэтому ее экстрагируют органическим растворителем, в котором она более устойчива, чем в воде. Реакцию необходимо вести без нагревания. При выполнении реакции должны отсутствовать другие окислители. Реакция очень специфична и используется как проверочная при определении Сr3+.
Выполнение реакции. Раствор, полученный в п. 1.4.4. охлаждают, добавляют к нему 10 капель амилового спирта, 3-4 капли перекиси водорода и встряхивают. В присутствии хрома слой органического растворителя окрашивается в синий цвет вследствие образования перекиси хрома.
1.4.6. Важное значение в анализе имеют также реакции Cr3+ с ацететом натрия гидрофосфатом натрия, окислительно-восстанови-тельные реакции с бромной водой, перманганатом калия и др.
Частные аналитические реакции ионов Zn2+
1.4.7. Раствор дитизона в хлороформе или четыреххлористом углеродедает с ионами Zn2+внутрикомплексную соль малиново-красного цвета.
Выполнение реакций. В пробирку поместить 2–3 капли раствора соли цинка, прибавить 2 мл ацетатного буферного раствора и 2–3 капли раствора дитизона в хлороформе. Перемешать и наблюдать малиновое окрашивание обоих слоев. В присутствии ионов цинка слой органического растворителя (CCl4) окрашивается в красный цвет. В отсутствие ионов Zn2+водный слой окрашивается в оранжевый цвет. Определению мешают А13+, Сr3+ и Sn2+.
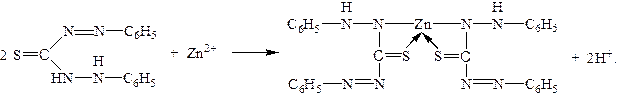
1.4.8. Гексацианоферрат(II) калия K4[Fe(CN)6] с ионами Zn2+ образует белый осадок гексацианоферрата(II) калия-цинка K2Zn3[Fe(CN)6]2, нерастворимый в разбавленной НС1:
2K+ + 3Zn2++2Fe(CN)64– → K2Zn3[Fe(CN)6]2↓.
Реакция позволяет открыть Zn2+-ион в присутствии А13+-иона.
Выполнение реакций. К 2–3 каплям раствора ZnCl2 прибавить 3–4 капли реактива. Полученный осадок исследовать на растворимость в 2 МНС1.
Частные аналитические реакции ионов Sn2+
Стандартный окислительно-восстановительный потенциал пары Sn4+/Sn2+ равен +0,15 В. Следовательно Sn2+ является довольно сильным восстановителем.
1.4.9. Соединения висмута(III) восстанавливаются солями олова (II) в щелочной среде до металлического висмута:
3Na2SnO2 + 2Bi(OH)3 → 2Вi↓+ 3Na2SnO3 + 3Н2О,
|
|
|
3 SnO22– + 2Bi(OH)3 → 2Bi↓ + 3SnO32– + 3Н2О.
Образование черного осадка металлического висмута свидетельствует о наличии в растворе иона Sn2+.
Выполнение реакций. Приготовить в пробирке раствор Na2SnO2. Для этого к 2–3 каплям 1 Мраствора SnCl2 прибавить 8–10 капель 2Мраствора NaOH (на холоде) до растворения первоначально выпавшего осадка Sn(OH)2 с образованием станнита. К полученному раствору прибавить 2–3 капли раствора соли висмута (III), перемешать. Выпадает черный осадок Bi.
Контрольные вопросы:
1. Какое свойство гидроксидов катионов III группы позволило выделить их в отдельную аналитическую группу?
2. Для каких катионов III группы характерны окислительно-восстановительные реакции?
3. Какие анионы образуются при окислении Сг3+ в щелочной среде? В кислой среде?
4. Каким способом можно выделить А1(ОН)3 и Sn(OH)4 из раствора алюмината и станната?
5. С помощью какого реактива можно отделить катион Zn2+ от остальных катионов III группы?
6. О чем свидетельствует отсутствие окраски раствора смеси катионов III группы?
7. В какой среде открывают ион цинка действием дитизона?
8. С какой целью при обнаружении А13+ ализарином капельным способом прибавляют K4[Fe(CN)6]?
 2015-05-13
2015-05-13 5268
5268
