Растворы, проводящие электрический ток, называются растворами электролитов. Существуют две основные причины прохождения элект-
рического тока через проводники: за счет переноса электронов и за счет переноса ионов. Электронная проводимость присуща многим металлам, ионная проводимость – многим химическим соединениям, обладающим ионным строением. Все вещества по их поведению в растворах делятся на две группы: а) вещества, растворы которых обладают ионной проводимостью (электролиты); б) вещества, растворы которых не обладают ионной проводимостью (неэлектролоты).
К электролитам относят большинство неорганических кислот, оснований и солей. К неэлектролитам относят многие органические соединения, например, спирты и углеводы.
Под электролитической диссоциацией понимают распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов – катионов и анионов.
Количественно процесс диссоциации характеризуется следующими величинами: степенью диссоциации a, изотоническим коэффициентом i, эквивалентной электропроводимостью l, константой электролитической диссоциации К дис.
|
|
|
Степень диссоциации a показывает, какая доля растворенного вещества продиссоциировала на ионы, т.е. характеризует силу электролита.
Она имеет разное значение для различных электролитов и определяет молярную электропроводимость растворов:
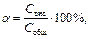
где С общ – общая концентрация растворенного вещества, моль/л; С дис – концентрация молекул, продиссоциировавших на ионы, моль/л.
Степень диссоциации электролита возрастает по мере разбавления раствора, может измеряться в долях единицы или в процентах:
a < 3% - электролит слабый и существует в растворе в виде молекул;
3 < a < 30% - электролит средней силы, при решении задач относить такие электролиты к слабым;
a > 30% - электролит сильный, существует в растворе в виде ионов;
a = 0, то диссоциация отсутствует;
a = 1 – полная диссоциация электролита (сильный электролит).
К процессу электролитической диссоциации можно применять принцип Ле-Шателье: для смещения равновесия слева направо, т.е. в сторону диссоциации, необходимо увеличить массу растворителя. Это означает, что диссоциация слабых электролитов проходит лучше в разбавленных растворах, чем в концентрированных, т.е. a возрастает с уменьшением концентрации электролита в растворе и a = 1 в бесконечно разбавленных растворах. Повышение температуры будет смещать равновесие слева направо, т.е. степень электролитической диссоциации слабого электролита – будет увеличиваться с повышением температуры.
Процесс диссоциации слабого электролита можно описать константой равновесия, которая называется константой диссоциации (К дис). Рассмотрим процесс диссоциации бинарного электролита KtAn.
|
|
|
Kt+An−⇆Kt+ + An−
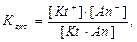
где [Kt+], [An-] - равновесные концентрации ионов катиона и аниона, моль/л; [KtAn] - равновесная концентрация недиссоциированных молекул электролита, моль/л.
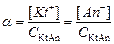 .
.
Отсюда сделав соответствующие преобразования, получаем: 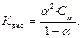 Полученная зависимость – это закон разбавления Оствальда. Для очень слабых электролитов a << 1, поэтому знаменателем можно пренебречь К дис = a2∙ Cm или
Полученная зависимость – это закон разбавления Оствальда. Для очень слабых электролитов a << 1, поэтому знаменателем можно пренебречь К дис = a2∙ Cm или 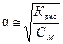 . Степень диссоциации электролита увеличивается с разбавлением.
. Степень диссоциации электролита увеличивается с разбавлением.
Степень диссоциации зависит от концентрации раствора электролита. Константа диссоциации слабого электролита зависит от природы растворителя и от температуры и не зависит от концентрации раствора и при постоянной температуре может служить мерой силы электролита. Чем меньше значение константы, тем слабее электролит. Для слабой кислоты концентрация ионов может быть рассчитана с использованием константы диссоциации.
Сильные электролиты диссоциируют практически полностью, необратимо в одну ступень на анионы и катионы, равновесие сдвинуто вправо.
Сильные кислоты: HCI, HBr, HI, HМnO4, HCIO4, HCIO3, H2CrO4, H2Cr2O7, H2SO4, HNO3, если К дис³ 10−1. Сильные основания: элементы IA группы (Li – Fr) и IIA (Са, Sr, Ba) и Tl. Средние соли – это сильные электролиты и диссоциируют в одну ступень.
H2SO4®2H+ + SO42−
Ca(OH)2®Са2+ + 2ОН−
FeCI3®Fe+3 + CI−
PbI2⇆Pb+2 + 2I−
Слабые электролиты диссоциируют обратимо и ступенчато, количество ступеней равно числу функциональных групп (Н+ или ОН−) в молекуле электролита, в каждой последующей происходит отрыв одной функциональной группы группы, равновесие сдвинуто влево. Заряд иона (аниона или катиона) численно равен номеру ступени.
Кислые соли – первичная диссоциация идет полностью, далее как у слабой кислоты. Основные соли – первичная диссоциация растворимой соли идет полностью и далее как слабого основания.
H2SO3⇆H+ + НSO3−
НSO3−®Н+ + SO32−
Сu(ОН)2⇆СuОН+ + ОН−
СuОН+→Сu2+ + ОН−
KHCO3⇆K+ + HCO3−
HCO3−®H+ + CO32−
AIOHCI2⇆AIOH+2 + 2CI−
AIOH+2®AI+3 + OH−
 2015-05-13
2015-05-13 1541
1541
