Пример 1. Определите возможность протекания реакции, ее тепловой эффект и изменение энтропии в реакции:
СН4(г) + 2O2(г) = СO2(к) + 2Н2О(г)
Решение. В соответствии со следствием из закона Гесса имеем
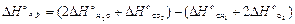
Изменение  и
и  определяем из уравнений:
определяем из уравнений:
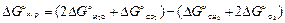
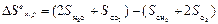
Используя табличные данные, получаем
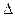 Н0 = (-241,98 · 2) + (-393,8) – (-74,86) = -802,9 кДж
Н0 = (-241,98 · 2) + (-393,8) – (-74,86) = -802,9 кДж
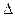 Go = (-228,8 × 2) + (-394,6) – (-50,85) = -801,35 кДж
Go = (-228,8 × 2) + (-394,6) – (-50,85) = -801,35 кДж
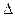 So = (188,9 · 2 +213,8) – (205,0 · 2 + 186,44) = -4,84 Дж
So = (188,9 · 2 +213,8) – (205,0 · 2 + 186,44) = -4,84 Дж
Так как 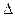 Go < 0, возможно самопроизвольное протекание реакции.
Go < 0, возможно самопроизвольное протекание реакции.
Термохимическое уравнение имеет вид
СН4(г) + 2O2(г) = СO2(к) + 2Н2О(г); 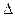 Н0 = -802,9кДж.
Н0 = -802,9кДж.
Пример 2. При сгорании 1 г графита до углекислого газа (при стандартных условиях) выделилось 32,8 кДж теплоты. Определите стандартную энтальпию образования CO2(г).
Решение. Запишем уравнение реакции:
С (графит) + О2(г) = СО2(г); 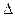 Н0 =?
Н0 =?
Очевидно, что для получения одного моля углекислого газа требуется сжечь 1 моль атомов углерода, т.е. 12 г.
Тепловой эффект сжигания
1 г графита – (-32,8) кДж
12 г − х кДж
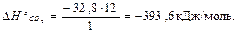
Вопросы для самоподготовки
1. Сформулируйте понятие энтальпии, энтропии, изобарно-изотермического потенциала (энергии Гиббса).
2. Сформулируйте закон Гесса. Почему химические и фазовые превращения сопровождаются выделением или поглощением энергии?
3. Почему тепловые эффекты реакций нейтрализации сильных кислот сильными основаниями одинаковы, а значения энтальпий реакции нейтрализации слабых кислот сильными основаниями и наоборот - различны?
4. При какой температуре наступит равновесие системы:
С(граф.) + СО2(г) = СО(г)?
5. Рассчитайте изменение энтальпии, энтропии и энергии Гиббса для реакции окисления NO в NO2 в стандартных условиях.
а. Возможна ли эта реакция при 25°С?
б. Какой фактор – энтальпийный или энтропийный – определяет знак 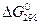 этой реакции?
этой реакции?
6. Какое количество теплоты выделится при сгорании 1 м3 метана, взятого при н.у., если при сгорании образуются Н2О и СО2?
7. При растворении 10 г CaCI2 в 200 см3 воды температура повысилась на 7,7 К. Вычислите теплоту гидратации CaCI2, если теплота растворения CaCI2 · 6H2O равна 19,08 кДж/моль. Удельную теплоемкость раствора можно принять равной удельной теплоемкости воды.
8. Какие из перечисленных оксидов могут быть восстановлены водородом до свободного металла при 298 К: CaO, SnO2, Cr2O3?
9. При полном сгорании этилена с образованием жидкой воды выделилось 6226 кДж теплоты. Найдите объем вступившего в реакцию кислорода (T = 25°C, P = 750 мм рт.ст.).
ТЕСТЫ
1. При восстановлении 12,7 г оксида меди (II) углем (с образованием СО) поглощается 100,8 кДж теплоты. Определить ΔH˚ образования CuO
а) - 635,0 кДж/моль;
б) -293,6 кДж/моль;
в) 348,3 кДж/моль;
г) 128,6 кДж/моль.
2. Энтальпия растворения CuSO4 · 5H2O в воде равна +117,7 кДж, а энтальпия гидратации CuSO4 равна – 77,8 кДж. Вычислить энтальпию растворения CuSO4.
а) 39,9 кДж;
б) 195,5 кДж/;
в) -195,5 кДж;
г) -28,6 кДж.
3. При сгорании 2 г графита до углекислого газа (стандартных условия) выделилось 65,6 кДж теплоты. Определить теплоту образования CO2(г).
а) 393,6 кДж/моль;
б) 264,3 кДж/моль;
в) 1028,3 кДж/моль;
г) – 444,5 кДж/моль.
4. Какое количество теплоты выделится при гашении 1 кг оксида кальция (тепловой эффект реакции равен –369,1 кДж/моль).
а) 3746 кДж;
б) 369,1 кДж;
в) 738,2 кДж;
г) 6591 кДж.
5. Сколько л азота, приведенных к н.у., участвовало в реакции с водородом при образовании аммиака, если при этом выделилось 18,45 кДж теплоты?
а) 8,43 л;
б) 22,4 л;
в) 4,47 л;
г) 11,2 л.
 2015-05-13
2015-05-13 7048
7048
