Уравнение диссоциации кислот (сильной и слабой):
H2SO4→2H+ + SO42− H2SO3⇆H+ + HSO32−
При расчете рН слабых кислот учитывается только 1 ступень диссоциации: Кдис1 > Кдис2.
| [H+] = n ∙ a ∙ CM | |
| Для сильных электролитов a = 1 | Для слабых электролитов |
| [H+] = n ∙ CM | 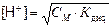
|
Ca(OH)2→Ca+2 + 2OH− Mg(OH)2⇆MgOH+ + OH−
| [OH−] = n ∙ a ∙ CM | |
| Для сильных электролитов a = 1 | Для слабых электролитов |
| [OH−] = n ∙ CM | 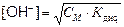
|
 2015-05-13
2015-05-13 414
414








