Химическая кинетика – это наука о скорости химических реакций, зависимости скорости от различных факторов и о механизме химического процесса, т.е. изучает закономерности протекания реакции во времени.
Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени в единице объема для гомогенных реакций и на единице поверхности раздела фаз для гетерогенных реакций:
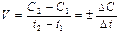
Скорость реакций зависит от числа соударений частиц друг с другом, поэтому твердые вещества решающего влияния на скорость химических реакций не оказывают. Знак "+" соответствует изменению концентрации продуктов реакции; знак "-" - исходных веществ.
Факторы, влияющие на скорость реакции:
1. концентрация реагирующих веществ;
2. температура;
3. энергия и энтропия активации;
4. наличие катализаторов;
5. природа реагирующих веществ;
6. среда, степень измельчения;
7. форма реактора, облучение.
Влияние концентрации реагентов на скорость реакции определяется законом действующих масс (Гульдберг и Вааге): при постоянной температуре скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих или образующихся веществ в степени равной их стехиометрическим коэффициентам (гомогенных систем).
Для взаимодействия aA + bB = cC + dD
Кинетические уравнения: для скорости прямой реакции выражается уравнением
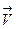 = k’ ∙ CaA∙ CbB,
= k’ ∙ CaA∙ CbB,
скорости обратной реакции
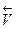 = k’∙ CсС CdD,
= k’∙ CсС CdD,
где k – константа скорости, зависит от температуры, природы реагирующих веществ, катализатора и не зависит от концентрации, давления, изменения объема; С - концентрации растворенных или газообразных соединений, моль/л; a, в, c, d - стехиометрические коэффициенты в уравнении реакции.
Физический смысл константы скорости (k): это скорость реакции в случае, если концентрации (моль/л) реагентов или их произведение равны единице.
Твердые вещества концентрации не имеют.
Если реакция протекает в газовой фазе, то в кинетическом уравнении используют давление (Р). Для расчета самой скорости прямой и обратной реакций, давление использовать нельзя, но можно для изменения скорости реакции.
Влияние температуры. С увеличением температуры увеличивается число столкновений молекул и растет скорость. Зависимость скорости реакции от температуры определяется эмпирическим (опытным) правилом Вант-Гоффа: при повышении температуры на каждые 10оС скорость реакции возрастает в 2-4 раза.
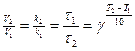 ,
,
где V2, V1 – скорости реакций; k2, k1 – константы скорости реакций; τ2, τ1 – время реакций при температурах Т 1 и Т2; g – температурный коэффициент, показывает во сколько раз уменьшается или увеличивается скорость химической реакции с изменением температуры на каждые 10оС.
Химическое равновесие – это состояние системы, при котором скорость прямой реакции равно скорости обратной реакции. Количественной характеристикой химического равновесия является константа химического равновесия К р, это величина постоянная.
Для реакции: aA + bB = cC + dD
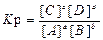
Константа равновесия не зависит от изменения концентрации любого из реагентов, продуктов реакции или катализатора.
Концентрации, установившиеся в момент равновесия называются равновесными, их обозначают [ ]. При величине константы равновесия можно судить о степени протекания реакции и ее преимущественном направлении.
Если К р>> 1, то идет преимущественно прямая реакция, если К р = 1, то система находится в кинетическом равновесии, если К р << 1 – идет обратная реакция, если DGо = 0 наступает термодинамическое равновесие.
Связь константы равновесия (К р) и свободной энергии Гиббса выражается следующей зависимостью:
DG о = -2,3× R × Т × lg K р
Если К р= 1, lg= 0 и DG = 0, DG = DН - Т ∙ DS = 0, тогда температуру, при которой состояние равновесия равно единице находят по формуле
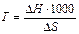 .
.
Переход из одного равновесного состояния в другое называется сдвигом равновесия. Смещение равновесия подчиняется принципу Ле-Шателье: если на систему, находящуюся в равновесии оказать какое-либо воздействие, то в системе усиливаются процессы, способствующие ослаблению этого воздействия.
На состояние равновесия можно оказывать влияние.
Влияние температуры: при повышении температуры равновесие смещается в сторону эндотермической реакции (DН > 0); при понижении температуры – в сторону экзотермической (DН < 0).
Влияние давления или объема: Изменение давления не влияет на систему, в которой нет газообразных веществ и когда количество молей газов слева и справа одинаково. При повышении давления равновесие смещается в сторону меньшего числа молей газов, при понижении – в сторону большего числа молей газов.
Влияние концентрации (для веществ в жидком и газообразном состояниях). Увеличение концентрации исходных веществ вызывает ускорение прямой реакции, добавление продуктов вызывает протекание обратной реакции. Изменение концентрации или давления может вызвать смещение равновесия, но константа равновесия при этом не меняется.
 2015-05-13
2015-05-13 1042
1042
