Карбонильный металлический порошок – металлический порошок, полученный разложением карбонильных соединений металлов.
В 1888 году английский химик Ланкер впервые открыл карбонил Ni(CO)4.
Получают порошки Ni, Fe, редко - Cr, Co, Mo, W и некоторых металлов платиновой группы (переходные металлы 5-7 групп периодической системы). Большинство карбонилов являются токсичными (ядовитыми) и процесс необходимо проводить с соблюдением соответствующих правил безопасности.
Характерные карбонилы:
Мē(СО)n
Ni(CO)4 – тетракарбонил Ni. Fe(CO)5 – пентокарбонил Fe.
Mē а Б в + сСО 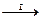 [ вБ] + ½Мē а(СО)с
[ вБ] + ½Мē а(СО)с 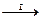 Мē a (СО)с ® a Мē + сСО
Мē a (СО)с ® a Мē + сСО
I – синтез карбонила – 50 ºС. – экзотермическая реакция
II – разложение карбонила и получение чистого Мē (200-250 ºС); эндотермическая реакция.
Строение карбонилов металлов объяснимо только с помощью координационной теории, разработанной для комплексных соединений. Карбонильные соединения не подчиняются классическим ионным, полярным, ковалентным связям. В карбонилах металлов группа СО как донор электронов занимает одно координационное место и присоединяется через атом углерода непосредственно к металлу координативной одинарной связью
Карбонилы металлов могут быть моно- и полиядерными. Экспериментально установлено, что карбонилы подчиняются правилу эффектного атомного номера (ЭАН), установленных для комплексных соединений Н. Сиджвиком. Эффективный атомный номер – число электронов в конфигурации атома инертного газа, замыкающего тот ряд периодической системы Менделеева, в котором помещается соответствующий металл, образующий карбонил.
В каждом ряду периодической системы Менделеева ЭАН для элементов этого ряда является число электронов в конфигурации атома инертного газа, замыкающего этот ряд.
2 He
10 Ne
18 Ar
36 Kr
54 Xc
86 Rn
Согласно Н. Сиджвику разность между эффективными атомными номерами и атомным номером металла показывает число электронов, которое необходимо приобрести металлу у лигандов.
В карбонильных соединениях металл выступает в качестве адцептора, а лиганды в качестве доноров электронов.
Формулу комплексного соединения можно рассчитать по уравнению
с= а/2 · (G - m - а+1) Мē а (СО)с
а- число ядер
с- число лиганд в карбонильном соединении
G- эффективный атомный номер (атомный номер ближайшего инертного газа)
m – атомный номер переходного металла V-VII групп.
26 Fe 36-26=10 СО отдает по 2е значит Fe(CO)5 ЭАН=36 Kr
По структурному признаку карбонилы металлов можно разделить на одноядерные и многоядерные:
§ одноядерные – с одним атомом металла в молекуле Fe(CO) 5, Ni (CO)4
§ многоядерные Me a (CO)c: монометаллические – с двумя или более одинаковыми атомами металла в молекуле Co2(CO)8, Fe2 (CO)9; полиметаллические – с двумя или более разными атомам металлов в молекуле, например
Mn 2Fe(CO)14, Mn ReFe(CO)14 ; смешанные – с атомами металлов и неметаллов СFe5 (CO)15
 2015-05-13
2015-05-13 732
732








