Одно из важнейших свойств открытых биологических и химических систем – это установление в них неравновесных стационарных состояний. Стационарные состояния в отличие от равновесных связаны с поддержанием в открытой системе постоянных во времени градиентов по определенным параметрам – T, P,C.
В стационарном состоянии:
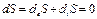
Однако члены deS и diS, соответствующие процессам обмена системы с окружающей средой и внутренним необратимым процессам, отличны от нуля. Возникает вопрос, каким образом изменение энтропии за счет самопроизвольных необратимых процессов внутри открытой системы может быть связаны с установлением в ней стационарного неравновесного состояния?
Рассмотрим открытую систему, в которой одновременно протекают необходимые процессы, характеризующиеся своими величинами скоростей и движущих сил. Будем считать, что эти превращения происходят вблизи от состояния термодинамического равновесия, где справедливо линейные соотношения между величинами скоростей и средства (потоками и движущими силами) и соотношения взаимности Онзагера.
Рассмотрим случай двух необратимых процессов:
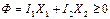 (1)
(1)
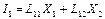
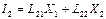 (2)
(2)
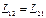
Пусть в стационарном состоянии I1=0. В случае химической реакции это может означать, что концентрация соответствующего промежуточного вещества постоянна во времени.
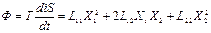 . (3)
. (3)
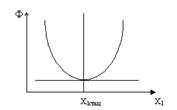
Нас интересует характер зависимости величины Ф(X1) при постоянном X2, когда X1 претерпевает такие изменения, которые в конечном итоге приводят к установлению стационарного состояния І1=0.
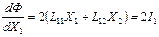 , (4)
, (4)
откуда следует
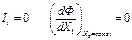 (5)
(5)
Условие 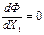 определяет существование минимума функции Ф(Х1,Х2) при постоянном Х2, поскольку величина Ф является положительным квадратичным выражением во всей области изменения независимого переменного Х1.
определяет существование минимума функции Ф(Х1,Х2) при постоянном Х2, поскольку величина Ф является положительным квадратичным выражением во всей области изменения независимого переменного Х1.
Аналогичным образом легко получить условие стационарности и для другого потока:
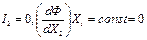 .
.
Следовательно, условие стационарности процесса оказывается эквивалентным условию минимума прироста энтропии. Это утверждение справедливо только для тех открытых систем, в которых выполняются линейные соотношения между величинами скоростей и движущих сил процессов.
При неизменных внешних условиях в частично равновесной открытой системе в стационарном состоянии, близком к термодинамическому равновесию, значение скорости прироста энтропии за счет внутренних необратимых процессов достигает отличного от нуля постоянного минимального положительного значения.
Принцип минимума прироста энтропии, или теорема Пригожина, представляет собой количественный критерий для определения общего направления самопроизвольных изменений в открытой системе, иными словами, критерий ее эволюции. По изменению величины ежесекундного прироста энтропии можно предсказать переход системы в конечное стационарное состояние, если все эти процессы протекают вблизи равновесия.
Вблизи равновесия величина Ф монотонно уменьшается, постепенно приближаясь к минимальному постоянному положительному значению по мере достижения конечного стационарного состояния.
Представим в виде графиков полученные выводы:
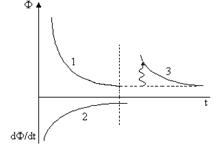
Если система находится в стационарном состоянии, то она не может самопроизвольно выйти из него за счет внутренних необратимых изменений. Если же в результате флуктуаций система незначительно удаляется от стационарного состояния, то в силу dФ>0 в ней должны произойти такие изменения, которые вновь возвратят ее к исходному стационарному состоянию. Это и означает, что данное стационарное состояние является устойчивым, а возвращение в него при незначительных возмущениях аналогично проявлению известного принципа Ле–Шателье – устойчивости равновесных состояний. Очевидно, условие устойчивости стационарного состояния имеет вид
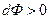
Знак положительного неравенства показывает, что любое отклонение от устойчивого стационарного состояния вызовет увеличение скорости продуцирования энтропии.
ПРИЛОЖЕНИЯ
Таблица 1.А. Неорганические соединения.*
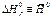 (кДж К-1 моль-1) (кДж К-1 моль-1) | 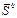 (кДж К--1 моль-1) (кДж К--1 моль-1) | 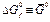 (кДж моль-1) (кДж моль-1) | |
| Ag(s) | 42,55 | ||
| Ag+ (aq)** | 105,579 | 72,68 | 77,107 |
| AgCl (s) | -127,068 | 96,2 | -109,789 |
| C(g) | 716,682 | 158,096 | 671,257 |
| С (s графит) | 5,740 | ||
| Ca (s, алмаз) | 1,895 | 2,377 | 2,900 |
| Ca(s) | 41,42 | ||
| СаСО3 (s, кальцит) | -1206,92 | 92,9 | -1128,79 |
| Cl2 (g) | 223,066 | ||
| CI- (aq) | -167,159 | 56,5 | -131,228 |
| CO(g) | -110,525 | 197,674 | -137,168 |
| CО2 (g) | -393,509 | 213,74 | -394,359 |
| CО2 (aq) | -413,80 | 117,6 | -385,98 |
| HCO-3; (aq) | -691,99 | 91,2 | -586,77 |
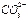 ; (aq) ; (aq) | -677,14 | -56,9 | -527,81 |
| Fe(s) | 27,28 | ||
| Fe2О3 (s) | -824,2 | 87,40 | -742,2 |
| H2(g) | 130,684 | ||
| H2О (g) | -241,887 | 188,825 | -228,572 |
| H2О(1) | -285,830 | 69,91 | -237,129 |
| H+ (aq) | |||
| OH- (aq) | -229,994 | -10,75 | -157,244 |
| H2О2 (aq) | -191,17 | 143,9 | -134,03 |
| H2S (g) | -20,63 | 205,79 | -33,56 |
| N2(g) | 191,61 | ||
| NH3 (g) | -46,11 | 192,45 | -16,45 |
| NH3 (aq) | -80,29 | 111,3 | -26,50 |
| NH; (aq) | -132,51 | 113,4 | -79,31 |
| NO(g) | 90,25 | 210,761 | 86,55 |
| NО2 (g) | 33,18 | 240,06 | 51,31 |
| NO; (aq) | -205,0 | 146,4 | -108,74 |
| Na+ (aq) | -240,12 | 59,0 | -261,905 |
| NaCl (s) | -411,153 | 72,13 | -384,138 |
| NaCl (aq) | -407,27 | 115,5 | -393,133 |
| NaOH (s) | -425,609 | 64,455 | -379,494 |
| О2 (g) | 205,138 | ||
| О3 (g) | 142,7 | 238,93 | 163,2 |
| S (ромбич.) | 31,80 | ||
| SО2 (g) | -296,830 | 248,22 | -300,194 |
| SО3 (g) | -395,72 | 256,76 | -371,06 |
* Стандартные термодинамические величины при 25°С (298 К) и давлении 1 атм. Значения для ионов относятся к водному раствору при активности 1 в молярной шкале. Даны стандартные энтальпии образования, 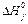 , энтропии из третьего закона термодинамики, S0, и величины стандартной свободной энергии образования Гиббса, , энтропии из третьего закона термодинамики, S0, и величины стандартной свободной энергии образования Гиббса, 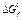 . ** Стандартное состояние для всех ионов и во всех случаях, где встречается обозначение (aq) — это растворенное вещество в шкале молярности. Обозначения: (g) — газ; (s) — твердое вещество; (1) — жидкость. Источник: The NBS Tables of Thermodynamic Properties, D.D. Wagmanet al., eds, J. Phys. Chem. Ref. Data, 11, Suppl 2 (1982). . ** Стандартное состояние для всех ионов и во всех случаях, где встречается обозначение (aq) — это растворенное вещество в шкале молярности. Обозначения: (g) — газ; (s) — твердое вещество; (1) — жидкость. Источник: The NBS Tables of Thermodynamic Properties, D.D. Wagmanet al., eds, J. Phys. Chem. Ref. Data, 11, Suppl 2 (1982). |
Таблица 1.Б. Углеводороды
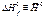 (кДж К-1 моль-1) (кДж К-1 моль-1) | 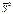 (кДж К-1 моль-1) (кДж К-1 моль-1) | 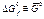 (кДж моль-1) (кДж моль-1) | |
| Ацетилен, С2Н2 (г) | 226,73 | 200,94 | 209,20 |
| Бензол, С6Н6 (г) | 82,93 | 269,20 | 129,66 |
| Бензол, С6Н6 (ж) | 49,04 | 173,26 | 124,35 |
| Н-Бутан, С4Н10 (г) | -126,15 | 310,12 | -17,15 |
| Циклогексан, С6Н12 (г) | -123,14 | 298,24 | 31,76 |
| Этан, С2Н6 (г) | -84,68 | 229,60 | -32,82 |
| Этилен, С2Н4 (г) | 52,26 | 219,56 | 68,15 |
| н-Гептан, С7Н6 (г) | -187,78 | 427,90 | 7,99 |
| н-Гексан, С6Н14 (г) | -167,19 | 388,40 | -0,25 |
| Изобутан, С4Н10 (г) | -134,52 | 294,64 | -20,88 |
| Метан, СН4 (г) | -74,81 | 186,264 | -50,72 |
| Нафталин, С10Н8 (т) | 150,96 | 335,64 | 223,59 |
| н-Октан, С8Н18 (г) | -208,45 | 466,73 | 16,40 |
| н-Пентан, С5Н12 (г) | -146,44 | 348,95 | -8,37 |
| Пропан, С3Н8 (г) | -103,85 | 269,91 | -23,47 |
| Пропилен, С3Н6 (г) | 20,42 | 266,94 | 62,72 |
* Стандартные термодинамические величины при 25°С (298 К) и давлении 1 атм. Даны стандартные энтальпии образования, 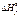 , , 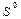 – энтропии из третьего закона термодинамики и величины стандартной свободной энергии образования Гиббса, – энтропии из третьего закона термодинамики и величины стандартной свободной энергии образования Гиббса, 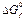 . Обозначения: (г) — газ, (ж) — жидкость; (т) — твердое вещество. Источник: D.R. Stall, E.F. Westrum, Jr., and G.C. Sinke. The Chemical Thermodynamics of Organic Compounds, John Willey, New York (1969). . Обозначения: (г) — газ, (ж) — жидкость; (т) — твердое вещество. Источник: D.R. Stall, E.F. Westrum, Jr., and G.C. Sinke. The Chemical Thermodynamics of Organic Compounds, John Willey, New York (1969). |
Таблица 1.В. Органические соединения.*
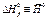 (кДж× К-1 ×моль-1) (кДж× К-1 ×моль-1) | 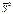 (кДж ×К-1× ×моль-1) (кДж ×К-1× ×моль-1) | 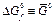 (кДж× моль-1) (кДж× моль-1) | 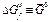 (Активность 1 М, aq) кДж ×К-1× моль-1 (Активность 1 М, aq) кДж ×К-1× моль-1 | |
| Ацетальдегид СН3СНО (г) | -166,36 | 264,22 | -133,30 | -139,24 |
| Ацетат- (aq) | - | - | - | -372,334 |
| Ацетил–CoA | - | - | - | -374,1a |
| Уксусная кислота (СН3СО2Н) (ж) | -484,1 | 159,83 | -389,36 | -396,60 |
| Ацетон СН3СОСН3 (ж) | -248,1 | 200,4 | -155,39 | -162,00 |
| Аденин C5H5NS (тв) | 95,98 | 151,00 | 299,49 | - |
| L-Аланин CH3CHNH2COOH (тв) | -562,7 | 129,20 | -370,24 | -371,71 |
| L-Аланинглицин C5H10N2O3 (тв) | -826,42 | 195,05 | -532,62 | - |
| L-аспартат+– (aq) | – | - | - | -698,69 |
| Аспартиновая кислота C4H7N2O4 (тв) | -973,37 | 170,12 | -730,23 | -719,98 |
| Бутановая кислота С3Н7СООН (тв) | –533,9 | 226,4 | –377,69 | – |
| Цитрат3- (aq) С6Н5O7 | – | – | – | –1168,34 |
| Креатин C4H9N3O2 (тв) | –537,18 | 189,5 | –264,93 | – |
| L-Цистеин HSCH2CHNH2COOH (тв) | –533,9 | 169,9 | –343,97 | –340,33 |
| L-Цистин C6H12N2O4S2(тв) | –1051,9 | 280,58 | –693,33 | –674,29 |
| Этанол С2Н5ОН (тв) | –276,98 | 160,67 | –174,14 | –180,92 |
| Формальдегид СН2О (г) | –115,90 | 218,78 | –109,91 | –130,5 |
| Формамид HCONH2 (г) | –186,2 | 248,45 | –141,04 | – |
| Муравьиная кислота НСООН (ж) | –424,76 | 128,95 | –361,46 | – |
| Фумарат- (aq) | – | – | – | –604,21 |
| Фумаровая кислота транс-(=СНСООН)2 (тв) | –811,07 | 166,1 | –653,67 | –646,05 |
| α-D-Галактоза С6Н12О6 (тв) | –1285,37 | 205,4 | –919,43 | –924,58 |
| α –D-Глюкоза С6Н12О6 (тв) | –1274,4 | 212,1 | –910,52 | –917,47 |
| L-Глутамат+– – (aq) | – | – | – | –694,00 |
| L-Глутаминовая кислота C5H9NO4 (тв) | –1009,68 | 118.20 | –731,28 | –722,70 |
| Глицерин НОСН2СНОНСН2ОН (ж) | –668,6 | 204,47 | –477,06 | –488,52 |
| Глицин H2CNH2COOH (тв) | –537,2 | 103,51 | –377,69 | –379,9 |
| Глицил-глицин C4H8N2О3 (тв) | –745,25 | 189,95 | –490,57 | – |
| Гуанин C5H5N5O (тв) | –183,93 | 160,2 | 47,40 | – |
| L-Изолейцин C6H13NO2 (тв) | –638,1 | 207,99 | –347,15 | |
| Лактат– (aq) | – | – | – | –517,812– |
| L-молочная кислота СН3СНОНСООН (тв) | –694,08 | 142.26 | –522,92 | – |
| β-Лактоза С12Н22О11 (тв) | –2236,72 | 386,2 | –1566,99 | –1569,92 |
| L-лейцин C6H13NО2 (тв) | –646,8 | 211,79 | –357,06 | –353,09 |
| Малеиновая кислота Цис-(=СНСООН)2 (тв) | –790,61 | 159,4 | –631,20 | – |
| Метанол СН3ОН (ж) | –238,57 | 126,8 | –166,23 | ––175,23 |
| L-метионин C5H11NО2S (тВ) | –758,6 | 231,08 | –505,76 | – |
| Щавелевая кислота (-СООН)2 (тв) | –829,94 | 120,08 | –701,15 | – |
| Оксалоацетат– – (aq) С4Н2О5 | – | – | – | –797,18 |
| L- Фенилаланин С9Н11О2 (тв) | –466,9 | 213,63 | –211,59 | – |
| Пируват– (aq) | – | – | – | –474,33 |
| Пировиноградная кислота СН3СОСООН (ж) | –584,5 | 179,5 | –463,38 | – |
| L-Серин HOCH2CHNH2COOH (тв) | –726,3 | 149,16 | –509,19 | – |
| Сукцинат2- (aq) | – | – | – | –690,23 |
| Сукцинат-CoA | – | – | – | –686,7a |
| Сахароза С12Н22О12 (тв) | –2222,1 | 360.2 | –1544,65 | –1551,76 |
| L-Триптофан CnH12N2О(тв) | –415,0 | 251,04 | –199,41 | – |
| L-Тирозин C9H11NО3 (тв) | –671,5 | 214,01 | –385,68 | –370,83 |
| Мочевина NH2CONH2 (ТВ) | –333,17 | 104,60 | –197,15 | –203,84 |
| L-Валин C5H11NО2 (тв) | –617,98 | 178,86 | –358,99 | – |
* Стандартные термодинамические величины при 25°С (298 К) и давлении 1 атм. Величины для ионов даны в водном растворе при активности 1 в молярной шкале. Приведены значения стандартных энтальпий образования 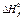 , энтропии , энтропии 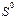 из третьего закона термодинамики и стандартной свободной энергии образования Гиббса из третьего закона термодинамики и стандартной свободной энергии образования Гиббса 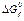 . Обозначения: (г) — газ, (ж) — жидкость, (тв) — твердое вещество; a– образование из элементов плюс свободная CoA. Источники: 1. D.K. Still, E.F. Westrum, Jr., and G.C. Sinke. The Chemical Thermodynamics of Organic compounds, Jom Wigley, New York (1969). 2. J.T. Edsall and Wyman. Biophysical Chemistry, Vol. 1, Academic Press, New York (1958). . Обозначения: (г) — газ, (ж) — жидкость, (тв) — твердое вещество; a– образование из элементов плюс свободная CoA. Источники: 1. D.K. Still, E.F. Westrum, Jr., and G.C. Sinke. The Chemical Thermodynamics of Organic compounds, Jom Wigley, New York (1969). 2. J.T. Edsall and Wyman. Biophysical Chemistry, Vol. 1, Academic Press, New York (1958). |
Таблица 2. Термодинамические функции биохимических конформационных переходов и нековалентных реакций, измеренные при комнатной температуре и нейтральном рН
| Переход или нековалентная реакция | 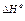 (кДж × моль-1) (кДж × моль-1) | 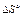 (кДж × К-1× моль-1) (кДж × К-1× моль-1) | Ссылка* |
| Переход спираль – клубок поли-L-глутамата в 1,0М растворе КС1 | 4,5/на амид | - | а |
| Денатурация лизоцима | ~450 | - | а |
| Переход от двухцепочечной структуры к одноцепочечной для РН в 1М растворе NaCl | ~ 40/на пару оснований | ~ 104/на пару оснований | b |
| Переход двойная спираль — одноцепочечная структура для ДН в 1М растворе NaCl | ~ 35/на пару оснований | ~ 88/на пару оснований | b |
| Несостыкованные основания полиадениловой кислоты в 0,1 М растворе КС1 | ~ 36/на нуклеотид | ~ 113/на нуклеотид | а |
| Связывание Мg– АТФ тетрагидрофолатсинтетазой | с | ||
| Связывание нетропсина поли dА • поли dТ | -9,2 | b | |
| а) G.D. Fasman ed. Handbook of Biochemistry and Molecular Biology. Vol. 1. 3d ed. (Cleveland; CRC Press, 1976. b) Landolt –Bornstein Numerical Data and Functional Ralationships in science and Technology, Group VII, Biophysics, vol 1d Necleic Acids (1990). c) N.P.Curthoys and C. Rabinowitz. J. Biol. Chem.–1971.–v. 246.–p. 6942. |
Таблица 3. Величины стандартной свободной энергии для ступенчатых реакций процесса метаболизма глюкозы при 25°С и рН 7
| Реакции | 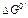 (кДж× моль-1) (кДж× моль-1) |
| D-глюкоза + АТФ ® D-глюкоза-6-фофат + АДФ | -16,7 |
| D-глюкоза-6-фосфат ® D-фруктоза-6-фосфат | + 1,7 |
| D-фруктоза-6-фосфат+АДФ ® D-фруктоза-1,6-дифосфат +АДФ | -14,2 |
| Фруктоза-1,6-дифосфат ® дигидроксиацетон фосфат + глиральдегид-3 –фосфат | +23,8 |
| Дигидроксиацетон фосфат ® глицеральдегид-3-фосфат | +7,5 |
| Глицеральдегид-3-фосфат + фосфат + NAD+ ® 1,3-дифосфоглицерат + NADH + Н+ | +6,3 |
| 1,3 -дифосфоглицерат + АДФ ® 3-фосфоглицерат + АТФ | -18,8 |
| 3 -фосфоглицерат ® 2-фосфоглицерат | +4,6 |
| 2-фосфоглицерат ® фосфоенолпируват + Н2О | +1,7 |
| 2- фосфоенолпируват + АДФ ® пируват + АТФ | -31,4 |
| Пируват + NADH + Н+ ® лактат + NAD+ | -25,1 |
| Пируват ® ацетальдегид + СО2 | -19,8 |
| Ацетальдегид + NADH + Н+ ® этанол + NAD+ | -23,7 |
 2015-05-13
2015-05-13 4870
4870








