Соли – это продукт полного или частичного замещения атомов водорода в молекуле кислоты на металл или же продукт полного или частичного замещения гидроксигрупп в основании на кислотный остаток
Соли принято делить на три группы: средние, кислые и основные. В средних солях все атомы водорода соответствующей кислоты замещены на металла, в кислых солях они замещенытолько частично, в основных солях группы ОН соответствующего основания частично замещены на кислотные остатки.
Существуют также некоторые другие типы солей, например: двойные соли, в которых содержатся два разных катиона и один анион: СаСО3.МgСО3 (доломит), КСl. NaСl (сильвинит), КАl(SО4)2 (алюмокалиевые квасцы); смешанные соли, в которых содержится один катион и два разных аниона: СаОСl2 (или Са(ОСl)Сl); комплексные соли, в состав которых входит комплексный ион, состоящий из центрального атома, связанного с несколькими лигандами: K4[Fе(СN)6] (желтая кровяная соль), К3[Fе(СN)6] (красная кровяная соль. Название солей образуется из названия аниона, за которым следует название катиона.
Для солей бескислородных кислот к названию неметалла добавляется суффикс-ид, например хлорид натрия NаСl, сульфид железа(II) FеS и др.
Кислые и основные соли можно рассматривать как продукт неполного превращения кислот и оснований. По международной номенклатуре атом водорода, входящий в состав кислой соли, обозначается приставкой гидро- а группа ОН — приставкой гидрокси-: NаНS — гидросульфид натрия, NаНSО3 — гидросульфит натрия, Mg(ОН)Сl—гидроксихлоридмагния, Аl(ОН)2Сl —дигидроксихлорид алюминия.
В названиях комплексных ионов сначала указываются лиганды. Название комплексного иона завершается названием металла с указанием соответствующей степени окисления (римскими цифрами в скобках).
В названиях комплексных катионов используются русские названия металлов, например: [Cu(NН3)4]Сl2— хлоридтетраамминмеди (II), (Аg(NH3)2)2SO4 —сульфат диамминсеребра (I).
Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса.
Соли бескислородных кислот, кроме того,могут быть получены при непосредственном взаимодействии металлов и неметаллов (Сl, S и т.д.).
Многие соли устойчивы при нагревании. Однако, соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются:
СаСО3 = СаО + СО2,
2Ag2СОЗ = 4Аg + 2СО2 + О2,
NН4Сl = NН3 + НСl,
2КNОЗ = 2КNО2 + О2,
2FеSО4 = Fе2О3 + SО2 + SО3,
4FеSО4 = 2Fе2ОЗ + 4SО2 + О2,
2Сu(NО3)2 = 2СuО + 4NО2 + О2,
2АgNО3 = 2Аg + 2NO2 + O2,
NН4NО3 = N2О + 2H2O
(NН4)2Сr2О7 = Сr2О3 + N2 + 4H2O,
2KClО3 2КCl + 3O2,
4KClO3 = ЗКClO4 + КСl.
При химических реакциях солей проявляются особенности как катионов, так и анионов, входящих в их состав. Ионы металлов, находящиеся в растворах, могут вступать в реакции с другими анионами с образованием нерастворимых соединений или же в окислительно-восстановительные реакции:
Ag+ + Br- = AgBr↓,
Cu2+ + 2OH- = Cu(OH)2↓,
Zn + Cu2+ = Zn2+ + Cu,
Cu + 2Ag+ = Cu2+ + 2Ag,
Fe2+ - e = Fe3+
Первые две реакции показывают, что соли могут реагировать с кислотами, солями или основаниями,а последние три указывают на окислительные и восстановительные свойства солей.
С другой стороны, анионы, входящие в состав солей, могут соединяться с катионами с образованием осадков или малодиссоциированных соединений,а также участвовать в окислительно-восстановительных реакциях:
Ba2+ + SO42- = BaSO4↓,
SO32- + 2H+ = SO2↑ + H2O,
4Fe3+ + 3[Fe(CN6)]4- = Fe4[Fe(CN)6]3,
«берлинская лазурь»
3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2,
«турнбуллева синь»
S2- + 2H+ = H2S↑,
NO3- + 2H+ + e = NO2↑ + H2O.
Таким образом, соли могут реагировать с солями, кислотами (по типу обмена), металлами и неметаллами.
Взаимодействие с металлами. Каждый левее стоящий металл в ряду напряжений вытесняет последующий из раствора его соли.
Fe+CuCI2=Cu+FeCI2
Fe°+Cu²++2CI=Cu°+Fe²++2CI
Fe°+Cu²+=Cu°+Fe²+
или Fe°–2e→ Fe²+ │ окисляется (восстановитель)
Cu²++2e→ Cu° │ восстанавливается (окислитель)
Взаимодействие со щелочами. В результате обязательно должно образоваться нерастворимое основание.
CuCI2+2NaOH=Cu(OH) 2 +2NaCl
4. Взаимодействие растворимых солей между собой с образованием осадка. Рассмотрим алгоритм составления уравнения реакций
NaCI+AgNO3= NaNO3+AgCl
Получение солей
1. Реакция нейтрализации.. После выпаривания воды получают кристаллическую соль.
| H2SO4 | + | 2 KOH | = | K2SO4 | + | 2 H2O |
| сульфат калия |
2. Реакция кислот с основными оксидами.
| H2SO4 | + | CuO | = | CuSO4 | + | H2O |
| сульфат меди |
3. Реакция оснований с кислотными оксидами
| Ca(OH)2 | + | CO2 | = | CaCO3↓ | + | H2O |
| карбонат кальция |
4. Реакция основных и кислотных оксидов между собой:
| CaO | + | SO3 | = | CaSO4 |
| сульфат кальция |
5. Реакция кислот с солями. Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок:
| H2S | + | CuCl2 | = | CuS↓ (осадок) | + | 2 HCl |
| сульфид меди |
6. Реакция оснований с солями. Для таких реакций подходят только щелочи (растворимые основания). В этих реакциях образуется другое основание и другая соль. Важно, чтобы новое основание не было щелочью и не могло реагировать с образовавшейся солью.
| 3 NaOH | + | FeCl3 | = | Fe(OH)3↓ | + | 3 NaCl |
| (осадок) | хлорид натрия |
7. Реакция двух различных солей. Реакцию удается провести только в том случае, если хотя бы одна из образующихся солей нерастворима и выпадает в осадок:
| AgNO3 | + | KCl | = | AgCl↓ (осадок) | + | KNO3 |
| хлорид серебра | нитрат калия |
Выпавшую в осадок соль отфильтровывают, а оставшийся раствор упаривают и получают другую соль. Если же обе образующиеся соли хорошо растворимы в воде, то реакции не происходит: в растворе существуют лишь ионы, не взаимодействующие между собой:
NaCl + KBr = Na+ + Cl- + K+ + Br-
Если такой раствор упарить, то мы получим смесь солей NaCl, KBr, NaBr и KCl, но чистые соли в таких реакциях получить не удается.
8. Реакция металлов с кислотами.
| Fe | + | H2SO4(разб.) | = | FeSO4 | + | H2 |
| сульфат железа II |
9. Реакция металлов с неметаллами. Эта реакция внешне напоминает горение. Металл "сгорает" в токе неметалла, образуя мельчайшие кристаллы соли, которые выглядят, как белый "дым":
| 2 K | + | Cl2 | = | 2 KCl |
| хлорид калия |
10. Реакция металлов с солями. Более активные металлы, расположенные в ряду активности левее, способны вытеснять менее активные (расположенные правее) металлы из их солей:
| Zn | + | CuSO4 | = | Cu | + | ZnSO4 |
| порошок меди | сульфат цинка |
Теперь рассмотрим химические свойства солей.
Наиболее распространенные реакции солей – реакции обмена и окислительно-восстановительные реакции. Сначала рассмотрим примеры окислительно-восстановительных реакций.
1. Окислительно-восстановительные реакции солей.
Поскольку соли состоят из ионов металла и кислотного остатка, их окислительно-восстановительные реакции условно можно разбить на две группы: реакции за счет иона металла и реакции за счет кислотного остатка, если в этом кислотном остатке какой-либо атом способен менять степень окисления.
а) Реакции за счет иона металла.
Поскольку в солях содержится ион металла в положительной степени окисления, они могут участвовать в окислительно-восстановительных реакциях, где ион металла играет роль окислителя. Восстановителем чаще всего служит какой-нибудь другой (более активный) металл. Приведем пример:
| Hg2+SO4 | + | Sn0 | = | Hg0 | + | Sn2+SO4 |
| соль менее активного металла (окислитель) | более активный металл (восстановитель) |
Принято говорить, что более активные металлы способны вытеснять другие металлы из их солей. Металлы, находящиеся в ряду активности, являются более активными.
б) Реакции за счет кислотного остатка.
В кислотных остатках часто имеются атомы, способные изменять степень окисления. Отсюда –многочисленные окислительно-восстановительные реакции солей с такими кислотными остатками. Например:
| Na2S–2 | + | Br20 | = | S0 | + | 2 NaBr–1 |
| соль сероводородной кислоты | сера |
| 2 KI–1 | + | H2O2–1 | + | H2SO4 | = | I20 | + | K2SO4 | + | 2 H2O–2 |
| соль иодоводородной кислоты | иод |
| 2 KMn+7O4 | + | 16 HCl–1 | = | 5 Cl20 | + | 2 KCl | + | 2 Mn+2Cl2 | + | 8 H2O |
| соль марганцевой кислоты | хлорид марганца |
| 2 Pb(N+5O3–2)2 | = | 2 PbO | + | 4 N+4O2 | + | O20 |
| соль азотной кислоты | при нагревании |
2. Обменные реакции солей.
Такие реакции могут происходить, когда соли реагируют: а) с кислотами, б) с щелочами, в) с другими солями. При проведении обменных реакций берут растворы солей. Общим требованием для таких реакций является образование малорастворимого продукта, который удаляется из раствора в виде осадка. Например:
а) CuSO4 + H2S = CuS↓ (осадок) + H2SO4
AgNO3 + HCl = AgCl↓ (осадок) + HNO3
б) FeCl3 + 3 NaOH = Fe(OH)3↓ (осадок) + 3 NaCl
CuSO4 + 2 KOH = Cu(OH)2↓ (осадок) + K2SO4
в) BaCl2 + K2SO4 = BaSO4↓ (осадок) + 2 KCl
CaCl2 + Na2CO3 = CaCO3↓ (осадок) + 2 NaCl
Если хотя бы один продукт таких обменных реакций не уходит из сферы реакции в виде осадка (иногда – в виде газа), то при смешивании растворов образуется только смесь ионов, на которые при растворении распадаются исходная соль и реагент. Таким образом, обменная реакция произойти не может.
Применение солей началось с незапамятных времен. Большинство солей широко используются в промышленности и в быту. Например, всем известно применение поваренной соли, т.е. хлорида натрия в быту. В промышленности он используется для получения гидроксида натрия, соды, хлора, натрия и т.д. Соли азотной и ортофосфорной кислот в основном являются минеральными удобрениями. Многие средства защиты растений от болезней, вредителей, некоторые лекарственные вещества тоже относятся к классу солей.
2. Крахмал, нахождение в природе, практическое значение, гидролиз крахмала.
КРАХМАЛ, главный резервный полисахарид растений; накапливается в виде зерен в клетках семян, луковиц, клубней, а также в листьях и стеблях. Бесцв. аморфное в-во, не раств. в холодной воде, диэтиловом эфире,этаноле, в горячей воде образует клейстер; В зернах крахмала содержатся 98-99,5%полисахаридов и 0,5-2% неуглеводных компонентов (в т.ч. липиды, белки, зольные элементы). Крахмал представляет собой смесь линейного (амилозы) и разветвленного (амилопектина) полисахаридов. Амилозапостроена гл. обр. из остатков a-D-глюкопиранозы с 1:4 - связями. В зависимости от вида растения молекула м.амилозы колеблется от 150 тыс. (рисовый, кукурузный крахмал) до 500 тыс. (картофельный крахмал).Молекулы амилопектина сильно разветвлены и состоят из фрагментов амилозы (ок. 20 моносахаридных остатков), связанных между собой 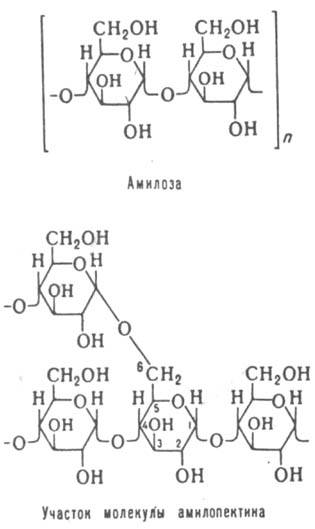
 2015-05-13
2015-05-13 1995
1995








