Эти изменения гемодинамики возможны при всех формах печёночно-клеточной недостаточности, но особенно — при декомпенсированном циррозе [35]. Они проявляются гиперемией конечностей, скачущим пульсом и капиллярной пульсацией. Периферический кровоток увеличивается, в основном за счёт кожного кровотока [24]. Усиливается приток артериальной крови в нижние конечности [6]. Увеличивается кровоток по воротной вене. Почечный кровоток, особенно перфузия коркового вещества, уменьшается. Увеличивается сердечный выброс [13, 29], что проявляется тахикардией, выраженным сердечным толчком, а во многих случаях и систолическим шумом (рис. 6-1 и 6-2). Эти изменения в системе кровообращения только в очень редких случаях приводят к сердечной недостаточности.
Артериальное давление низкое; в терминальной фазе это усугубляет нарушение функции почек. Нарушение кровотока в печени способствует развитию печёночной недостаточности, а снижение церебрального кровотока усугубляет нарушение психического статуса |10]. Такая артериальная гипотензия опасна для жизни, однако попытки повысить объём циркулирующей крови гемотрансфузиями или лекарственными препаратами (например, допамином) приводят только к кратковременному улучшению (см. рис. 9-13).
|
|
|
Периферическое сосудистое сопротивление уменьшается, как и артериовенозная разница по кислороду. При циррозе общее потребление кислорода организмом и оксигенация тканей снижаются [28]. Это связано с гипердинамическим типом кровообращения и с артериовенозным шунтированием. Таким образом, состояние повышенной вазодилатации при печёночной недостаточности может способствовать общей гипоксии тканей.
Тонус мышц сосудов понижается; доказательством этому служит сниженная вазоконстрикция при умственных нагрузках, при пробе Вальсальвы и при переходе из горизонтального положения тела в вертикальное |23, 24]. Поражение вегетативных нервов прогностически неблагоприятно [7]. Под влиянием сосудорасширяющих веществ, по-видимому, происходит раскрытие большого количества существующих, но неактивных в норме артериовенозных анастомозов. Эффективный объём артериальной крови падает, поскольку дилатация артериол приводит к увеличению артериального сосудистого объёма. В результате этого активируются симпатическая и ренин-ангиотензиновая системы и происходит задержка натрия и воды с развитием асцита (см. главу 9). Показано, что гиперкинетический тип кровообращения во внутренних органах связан с портальной гипертензией (см. главу 10).
Вазодилататоры, принимающие участие в изменениях гемодинамики, точно не установлены. Вероятно, их несколько. Какова бы ни была их природа, они зависят от поражённых гепатоцитов: либо синтезируются в них, либо недостаточно инактивируются, либо минуют их через внутри- или вне-печёночные портосистемные шунты. Вероятно, вазодилататоры образуются в кишечнике. При циррозе повышенная проницаемость слизистой оболочки кишечника и портосистемное шунтирование позволяют эндотоксину и цитокинам проникать в системное русло, что, возможно, и обусловливает наблюдаемые изменения [21, 22].
|
|
|
Оксид азота (NO), оказывающий мощное сосудорасширяющее действие (рис. 6-3), может служить причиной гипердинамического кровообращения и, следовательно, развития асцита, гепаторенального синдрома (см. главу 9) и портальной гипертензии (см. главу 10) [38j. NO синтезируется в эндотелии из L-аргинина; его действие связано с инактивацией гуанилатциклазы. Активностью NO-синтетазы можно управлять; эту реакцию подавляют аналоги
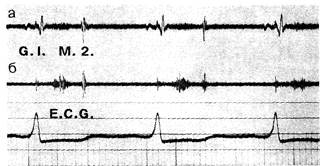
Рис. 6-1. ФКГ на верхушке (а) и на основании (б) сердца при циррозе печени. Выявляются систолический шум изгнания (М) и предсердный шум — пресистолический ритм галопа (G) [23].
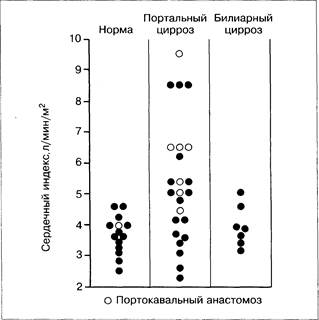
Рис. 6-2. Сердечный выброс при циррозе печени во многих случаях повышен, но при билиарном циррозе остается нормальным. В норме сердечный индекс составляет в среднем 3,68±0,60 л/мин/м3, при циррозе печени — в среднем 5,36±1,98л/мин/м2 f29].
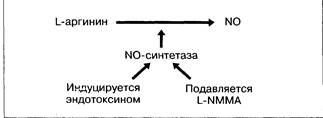
Рис. 6-3. Оксид азота (NO) — основной вазодилататор. Он образуется из L-аргинина с помощью фермента NО-синтетазы. Она может быть индуцирована эндотоксином и подавлена L-NMMA.
L-аргинина, например NG-монометил-L-аргинин (L-NMMA). Показано, что применение этих веществ устраняет многие сосудорасширяющие эффекты NO. У крыс с портальной гипертензией они уменьшали проявления гипердинамического кровообращения [19]. При циррозе печени у этих животных чувствительность к прессорному действию ингибиторов NO повышена; их введение повышает давление в воротной вене [30]. NO-синтетазу можно индуцировать стимуляцией бактериальным эндотоксином или цитокинами [26].
На кровообращение в воротной вене различные гастроинтестинальные пептиды, например вазоактивный интестинальный полипептид, субстанция Р и пептид, связанный с геном кальцитонина CGRP (II) [2], оказывают небольшое влияние. Глюкагон оказывает сосудорасширяющее действие и усиливает кровоток по непарной вене у больных циррозом, но мало влияет на сердечный индекс или на гемодинамику; таким образом, он почти не оказывает воздействия на системное сосудистое сопротивление [20]. Маловероятно, чтобы он был единственным вазодилататором, вызывающим описанные изменения.
Простагландины (El, E2 и Е12) обладают сосудорасширяющими свойствами; показано, что при хронических заболеваниях печени в воротную вену выделяются простаноиды [40]. Возможно, они частично обусловливают вазодилатацию.
При циррозе реактивность артерий на эндогенные вазоконстрикторы снижена [27].
После трансплантации печени давление в воротной вене нормализуется, однако сохранение портосистемного коллатерального кровообращения не позволяет снижаться сердечному индексу и кровообращению во внутренних органах [9, 11].
Печёночно-лёгочный синдром [18]
Почти в трети случаев декомпенсированного цирроза насыщение артериальной крови кислородом уменьшено; у некоторых больных отмечается цианоз [32] (табл. 6-1, рис. 6-4). Вероятно, причиной этого является внутрилегочное шунтирование крови через микроскопические артериовенозные фистулы [12, 34]. Исследование лёгочной артерии методом инъекционных препаратов при циррозе печени выявляет значительное расширение её тонких периферических ветвей как в лёгочной ткани, так и в плевре, где в некоторых случаях наблюдаются сосудистые звёздочки (рис. 6-5) [3]. Изредка артериовенозные шунты в лёгких удаётся выявить при ангиопульмонографии (рис. 6-6). При катетеризации сердца больного циррозом печени с цианозом, выявлено шунтирование справа налево; при физической нагрузке насыщение артериальной
|
|
|
Таблица 6-1. Изменения в лёгких, осложняющие хроническое печёночно-клеточное заболевание
| Гипоксия | Высокое стояние диафрагмы |
| Внутрилегочное шунтирование крови | Базальный ателектаз |
| Нарушение вентиляционно-перфузионного соотношения | Первичная лёгочная гипертензия Портопульмональное шунтирование |
| Снижение уровня фактора переноса | Пятнистость лёгочного рисунка при рентгенографии |
| Плевральный выпот |
крови кислородом уменьшалось с 91 до 68%. Доказать наличие таких шунтов можно при аутопсии, заполняя сосудистое русло лёгких желатином с контрастным веществом [3].
Расширение сосудов лёгких и артериовенозное шунтирование можно выявить при эхокардиографии с контрастированием [16]. При сканировании лёгких с 99mТc, связанным с альбумином, или при ангиопульмонографии выявляется губчатое строение сосудов базальных отделов лёгких, соответствующее участкам инфильтрации на рентгенограммах.
Снижение диффузионной способности развивается при отсутствии рестриктивных нарушений вентиляции [37]. Вероятно, оно обусловлено расширением мелких кровеносных сосудов лёгких, осложняющим как далеко зашедший цирроз, так и фульминантную печёночную недостаточность [3, 36, 42]. Во всех случаях выявляется снижение уровня фактора переноса, вероятно, связанное с утолщением стенок мелких вен и капилляров слоем коллагена [36].
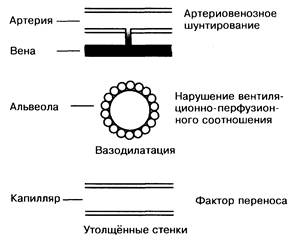
Рис. 6-4. Изменения в лёгких при печёночно-клеточной недостаточности.
Расширение сосудов лёгких сочетается с низким сопротивлением в них, которое не изменяется при гипоксии или нагрузке [1]. Это также ведёт к нарушению вентиляционно-перфузионного соотношения в лёгких [33|. Даже при сохранении вазоконстрикторной реакции лёгких на гипоксию давление в лёгочной артерии на фоне гипоксии и повышения уровня диоксида углерода оказывается сниженным. Показано образование портопульмональных анастомозов, но маловероятно, чтобы они влияли на уменьшение насыщения крови кислородом, поскольку в воротной вене содержание кислорода высокое. Кроме того, кровоток по ним, вероятно, незначителен.
|
|
|
Наконец, снижению функции лёгких при циррозе печени могут способствовать высокое стояние диафрагмы (вследствие гепатомегалии или значительного асцита), плевральный выпот или хронические заболевания лёгких на фоне злостного курения и алкоголизма.
Симптом «барабанных палочек» выявляется часто, но он не всегда связан с цианозом и увеличением сердечного индекса. Обычно развиваются затруднение дыхания при вставании (платипноэ) и снижение оксигенации в положении стоя (ортодеоксия)|15|.
Наиболее выраженный цианоз и симптом «барабанных палочек» наблюдаются при хроническом активном гепатите и длительно существующем циррозе. При улучшении функции печени уменьшаются как цианоз, так и тени узлов в лёгочной ткани на рентгенограммах грудной клетки.
Механизм этих изменений остаётся неясным. Вероятно, их вызывает вещество, расширяющее сосуды лёгких, но связано ли это с нарушением синтеза или с нарушением метаболизма в поражённой печени, неизвестно |14].
Связь с трансплантацией печени
При подготовке к трансплантации печени следует обязательно провести исследование лёгких [14]. Необходимо выполнить рентгенографию грудной клетки. Следует определить РаО2, в положении больного стоя и лёжа, чтобы выявить ортодеоксию, которая указывает на вазодилатацию в лёгких. Её подтверждают с помощью контрастной эхокардиографии |15|. Кроме того, вазодилатацию в лёгких можно подтвердить при сканировании с 99m'Тc, связанным с альбумином [15|.
После трансплантации печени внутрилегочное шунтирование, особенно диффузная прекапиллярная вазодилатация, уменьшается (рис. 6-7) [39]. У детей внутрилегочное шунтирование подвергается обратному развитию в течение нескольких недель после операции 117). При крупных внутрилегочных
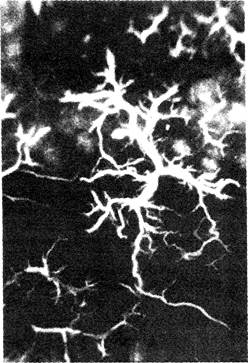
Рис. 6-5. Цирроз печени. На макропрепарате плевры видно расширение сосудов, напоминающее сосудистые звездочки |3|.
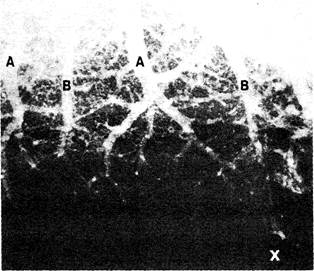
Рис. 6-6. Артериограмма больного циррозом печени (срез на уровне базальных отделов левого лёгкого). Артерии (А) и вены (В) чередуются, видны артериовенозный шунт (X) и образующая его крупная артериальная ветвь. Для контрастирования использована бариевая взвесь [3|.
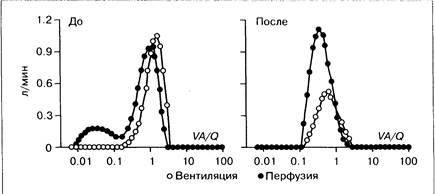
Рис. 6-7. Метод элиминации инертных газов выявляет прекращение внутрилегочного шунтирования и нормализацию вентиляционно-перфузионного соотношения после трансплантации печени [5|.
артериовенозных шунтах обратное развитие наблюдается не всегда и может потребоваться эмболизация спиралью, которую следует выполнить до трансплантации [31].
 2015-06-10
2015-06-10 4712
4712








