1. Составьте глоссарий по изучаемой теме. Включите в него следующие и другие (самостоятельно подобранные по данной теме) термины: теплоемкость, теплота, работа расширения газа, энтропия (ОК-1, ПК- 19)
2. Изучите и запомните следующие формулы (ПК-1, ПК-19)
| Наименование величины или физический закон | Формула |
| Внутренняя энергия газа | 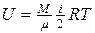 |
Количество теплоты, необходимой для нагревания тела с удельной теплоемкостью  от температуры Т1 до температуры Т2 от температуры Т1 до температуры Т2 | 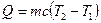 |
| Теплота парообразования (r — удельная теплота парообразования) | 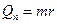 |
| Первый закон термодинамики в различных процессах | Изохорный процесс 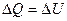 Изотермический процесс Изотермический процесс 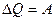 Изобарный процесс Изобарный процесс 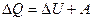 Адиабатный процесс Адиабатный процесс 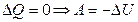 |
| Работа газа в различных процессах | Изохорный процесс А =0 Изотермический процесс 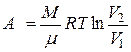 Изобарный процесс A =p( V2-V1 ) Адиабатный процесс Изобарный процесс A =p( V2-V1 ) Адиабатный процесс 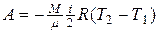 |
| Уравнение Майера для молярных теплоемкостей газа в изохорном и изобарном процессах | Cp = Cv + R, где Cv = iR/2 |
| Уравнение Пуассона, связывающее параметры газа в адиабатном процессе | 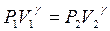 , где γ = Ср /Сv , где γ = Ср /Сv |
| КПД любого теплового двигателя | 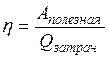 |
| КПД идеального теплового двигателя | 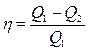 |
| КПД двигателя Карно | 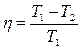 |
| Элементарное изменение энтропии | 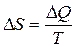 |
| Изменение энтропии в изохорном процессе | 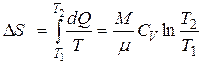 |
| Изменение энтропии в изотермическом процессе | 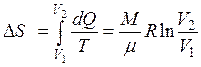 |
| Изменение энтропии в изобарном процессе | 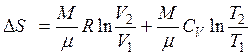 |
| Изменение энтропии в цикле Карно | 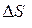 = 0 = 0 |
| Изменение энтропии в адиабатном процессе | 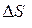 = 0 = 0 |
Разберите самостоятельно следующие задачи (ОК-1, ПК-1, ПК- 3, ПК-19)
Задача 1
Найти отношение удельных теплоемкостей при постоянном давлении и постоянном объеме для кислорода.
Решение. Отношение удельных теплоемкостей при постоянном давлении и постоянном объеме идеального газа равно отношению его молярных теплоемкостей при постоянном давлении и постоянном объеме:
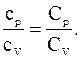
Зная, что молярные теплоемкости при постоянном давлении и при постоянном объеме связаны с числом степеней свободы и равны:
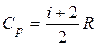 и
и 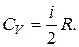
Для отношения удельных теплоемкостей будем иметь
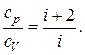
Кислород двухатомный газ, следовательно, число степеней свободы i=5. Подставляя значение i в вышезаписанную формулу, имеем
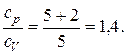
Ответ: сp/cV=1,4.
Задача 2
Удельная теплоемкость некоторого двухатомного газа равна 14,7 кДж/(кг×К). Найти молярную массу этого газа.
Решение. Известно, что удельная теплоемкость при постоянном давлении связана с молярной теплоемкостью газа:
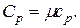
Молярная теплоемкость при постоянном давлении
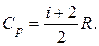
где i – число степеней свободы газа.
Таким образом:
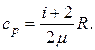
Откуда
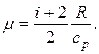
Подставляя в полученную формулу значения величин данных в условии задачи, с учетом того, что для двухатомного газа i=5, будем иметь:
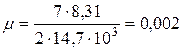
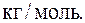
Ответ: μ=0,002 кг/моль.
Задача 3
Вычислить удельные теплоемкости при постоянном объеме и постоянном давлении смеси неона и водорода, если массовые доли неона и водорода составляют w1=80% и w2=20% соответственно. Удельные теплоемкости для неона сv=6,24×102 Дж/(кг×К), сp=1,04×103 Дж/(кг×К); для водорода – сv=1,04×104 Дж/(кг×К), сp=1,46×104 Дж/(кг×К).
Решение. В общем случае количество тепла необходимого для нагревания смеси газов, например, при нагревании в условиях постоянного объема от температуры Т1 до температуры Т2 равна:
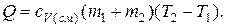
где сv(см) – удельная теплоемкость смеси;
(m1+m2) – масса смеси;
(T2-T1) – изменение температуры.
С другой стороны это количество тепла может быть вычислено по формуле:
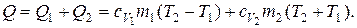
где Q1 и Q1 – соответственно количество тепла, которое необходимо сообщить,чтобы изменить температуру неона и водорода в отдельности;
сv1 и сv2 – удельные теплоемкости неона и водорода при постоянном объеме;
m1 и m2 – массы неона и водорода.
Таким образом, имеем:
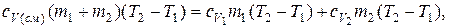
или
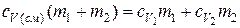 .
.
Откуда
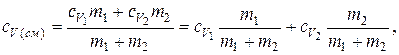
где 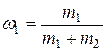 и
и 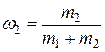 – массовые доли неона и водорода соответственно.
– массовые доли неона и водорода соответственно.
Подставляя численные значения для удельной теплоемкости смеси неона и водорода при постоянном давлении, будем иметь:
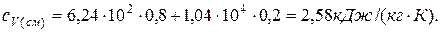
Аналогично можно получить формулу для определения удельной теплоемкости смеси неона и водорода при постоянном давлении:
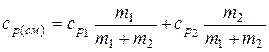 .
.
Подставляя численные значения для удельной теплоемкости смеси при постоянном давлении, будем иметь:
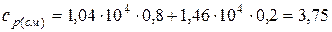
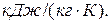
Ответ: 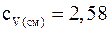
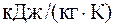 ;
; 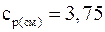
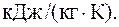
Задача 4
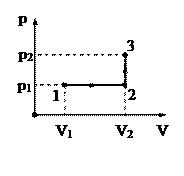 Кислород массой 2 кг занимает объем V1=1 м3 и находится под давлением p1=0,2 МПа (см.рис.). Газ был нагрет сначала при постоянном давлении до объема V2=3 м3, а затем при постоянном объеме до давления p3=0,5 МПа. Найти изменение внутренней энергии газа.
Кислород массой 2 кг занимает объем V1=1 м3 и находится под давлением p1=0,2 МПа (см.рис.). Газ был нагрет сначала при постоянном давлении до объема V2=3 м3, а затем при постоянном объеме до давления p3=0,5 МПа. Найти изменение внутренней энергии газа.
Решение. Изменение внутренней энергии газа
ΔU=cvmΔT,
где cv=iR/2μ – удельная теплоемкость при постоянном объеме;
μ – молярная масса газа;
ΔТ=(Т3-Т1) – изменение температуры газа в конечном и начальном состояниях;
i=5 – число степеней свободы (кислород двухатомный газ).
Температуру газа в начальном и конечном состояниях можно определить из уравнения Менделеева–Клапейрона:
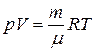 .
.
Для начальной температуры
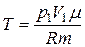 .
.
Для конечной температуры
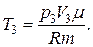
Тогда изменение внутренней энергии газа
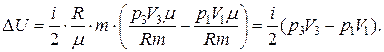
Подставляя численные значения, будем иметь
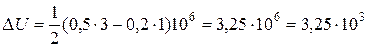 Дж.
Дж.
Ответ: ΔU=3,25 кДж.
Задача 5
Кислород массой 2 кг занимает объем V1=1 м3 и находится под давлением p1=0,2 МПа. Газ был нагрет сначала при постоянном давлении до объема V2=3 м3, а затем при постоянном объеме до давления p3=0,5 МПа. Найти работу, совершенную газом, и теплоту, переданную газу (рис. 3.9).
Решение. Из уравнения Менделеева–Клапейрона
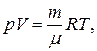
можно определить температуры, характерные для соответствующих состояний:
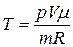 .
.
Таким образом, температура газа в начальном состоянии
T1=p1V1m/mR;
в промежуточном
T2=p2V2m/mR;
в конечном
T3=p3V3 m/mR.
В процессе перехода газ совершал работу
A=A1+A2,
где A1 – работа газа, совершенная при переходе в условиях постоянного давления;
A2 – работа газа, совершенная при переходе в условиях постоянного объема.
Работа газа, совершенная при переходе в условиях постоянного давления определяется соотношением:
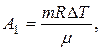
а работа газа, совершенная при переходе в условиях постоянного объема 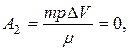 т.к. DV=0.
т.к. DV=0.
Таким образом, в данном случае
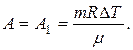
Количество тепла, переданного газу равно сумме изменения его внутренней энергии и работы, совершенной им:
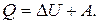
Известно, что изменение внутренней энергии газа пропорционально изменению его температуры, при этом
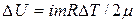 .
.
Следовательно, для изменения внутренней энергии газа при его переходе из начального в конечное состояние, имеем:
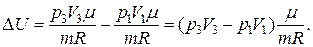
где DТ=T3–T1.
Таким образом, для количества тепла переданного газу имеем:
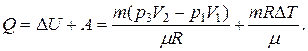
Подставив численные значения величин, будем иметь:
Т1=0,2×106×1×32×10–3/(8,31×103×2)=385 К;
Т2=0,2×106×3×32×10–3/(8,31×103×2)=1155 К;
Т3=0,5×106×3×32×10–3/(8,31×103×2)=2888 К;
DU=5×2×8,31×(2888–385)/(2×32×10–3)=3,25×103 Дж;
A=2×8,31×(1155–385)/32×10–3=0,4×103 Дж;
Q=3,25×103+0,4×103=3,65×103 Дж.
Ответ: A=Дж; Q=3,65×103 Дж.
Задача 6
Масса m=10 г кислорода находится под давлением p=0,3 МПа и при температуре 10 oС. После нагревания при постоянном давлении газ занял объем V2=10 л. Найти количество теплоты Q, полученное газом, и энергию теплового движения молекул газа W до и после нагревания.
Решение. Количество теплоты Q, полученное газом в процессе нагревания
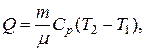
где 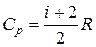 – молярная теплоемкость газа при постоянном давлении;
– молярная теплоемкость газа при постоянном давлении;
i=5 – число степеней свободы (кислород двухатомный газ);
R=8,31 Дж/(моль×К) – универсальная газовая постоянная;
m=0,032 кг/моль – молекулярная масса кислорода;
T1 и T2 – температуры газа в начальном и конечном состояниях. Для определения температуры газа в конечном состоянии воспользуемся соотношением между температурой и объемом газа, нагреваемого в условиях постоянного давления:
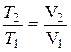 .
.
Откуда
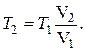
Воспользовавшись уравнением Менделеева–Клапейрона, записанным в виде
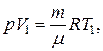
находим объем газа в начальном состоянии:
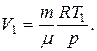
Для конечной температуры будем иметь соотношение:
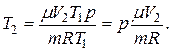
Подставляя численные значения, определяем конечную температуру газа:
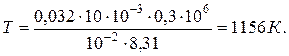
Подставляя численные значения, находим количество теплоты, полученное газом в процессе нагревания:
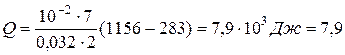
Энергию теплового движения молекул газа можно определить по формуле
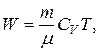
где CV=iR/2 – молярная теплоемкость газа при постоянном объеме.
Таким образом, для энергии теплового движения молекул газа в начальном состоянии имеем:
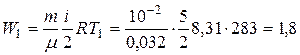
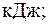
в конечном состоянии
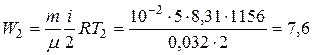
 .
.
Ответ:Q=7,9 кДж; W1=1,8 кДж; W2=7,6 кДж.
Задача 7
В цилиндре под поршнем находится водород массой m=0,02 кг при температуре T1=300 К. Водород сначала расширялся адиабатно, увеличив свой объем в пять раз, а затем был сжат изотермически, причем объем газа уменьшился в пять раз. Найти температуру в конце адиабатного расширения и работу, совершаемую газом при этих процессах.
Решение. Температуры и объемы газа, совершающего адиабатный процесс, связаны между собой соотношением
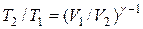 или
или 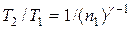 ,
,
где g – отношение теплоемкостей газа при постоянном давлении и постоянном объеме;
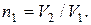
Отсюда получаем следующее выражение для конечной температуры:
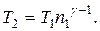
Работа газа при адиабатном расширении может быть определена по формуле
A=mCV(T1-T2)/m,
где CV – молярная теплоемкость газа при постоянном объеме.
Работа A2 газа при изотермическом процессе может быть выражена в виде:
A2=mRT2ln(V3/V2)/m, или A2=mRT2ln(1/n2)/m,
где 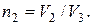
Выразив все величины в единицах СИ, подставив их в соответствующие формулы, произведем вычисления, учитывая, что для водорода как для двухатомного газа g=1,4, i=5 и m=2×10-3 кг/моль, получим:
T2=157 К;
A1=29,8 кДж;
A=-21 кДж.
Знак минус показывает, что при сжатии работа совершается над газом внешними силами.
Ответ: T2=157 К; A1=29,8 кДж; A=-21 кДж.
Задача 8
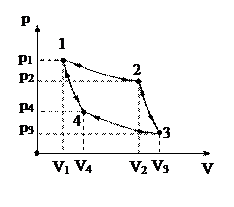 Тепловая машина работает по обратимому циклу Карно. Температура теплоотдатчика T1=500 К (см. рис.). Определить термический КПД h цикла и температуру T2 теплоприемника тепловой машины, если за счет каждого килоджоуля теплоты, полученной от теплоотдатчика, машина совершает работу A=350 Дж.
Тепловая машина работает по обратимому циклу Карно. Температура теплоотдатчика T1=500 К (см. рис.). Определить термический КПД h цикла и температуру T2 теплоприемника тепловой машины, если за счет каждого килоджоуля теплоты, полученной от теплоотдатчика, машина совершает работу A=350 Дж.
Решение. Термический КПД тепловой машины показывает, какая доля теплоты, полученной от теплоотдатчика, превращается в механическую работу. Термический КПД выражается формулой
h=A/Q1=(Т1-Т2)/Т1,
где Q – теплота полученная от теплоотдатчика;
A – работа, совершенная рабочим телом тепловой машины;
T1 – температура теплоотдатчика;
T2 – температура теплоприемника.
Зная КПД цикла, по формуле T2=T1×(1-h) можно определить температуру теплоприемника.
В условии задачи все величины представлены в единицах СИ, подставив их в соответствующие формулы, произведя вычисления, получим:
h=350/1000=0,35;
T2=500×(1-0,35)=325 К.
Ответ: h=0,35; T2=325 К.
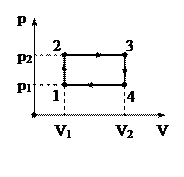 Задача 9
Задача 9
Идеальный трехатомный газ совершает цикл, состоящий из изохоры (1–2), изобары (2–3), изохоры (3–4) и изобары (4–1). Определить КПД цикла, если V1=1,00 л, V2=2,00 л, p1=1,0 атм, p2=2,0 атм. Считая величины V1, V2, p1, p2 переменными, принимающими любые положительные значения, найти предельный (наибольший) КПД данного цикла (см. рис.).
Решение. Рассмотрим процессы цикла по порядку.
1. Первый процесс. Объем V1 газа сохраняется, при этом давление его увеличивается от p1 до p2. Так как при изохорном процессе давление газа пропорционально его абсолютной температуре, видим, что температура газа здесь повышается. Следовательно, газ при этом получает (от нагревателя) количество тепла Q12.
2. Второй процесс. Давление p2 газа сохраняется, объем же увеличивается от V1 до V2, при этом газ совершает работу, равную
A23=p2(V2-V1).
Так как при изобарном процессе объем газа пропорционален абсолютной температуре, видим, что температура газа и в этом процессе повышалась. Следовательно, и здесь газ получил количество теплоты Q23.
3. Третий процесс. Процесс идет изохорно (V2=const), давление газа уменьшается от p2 до p1, что означает понижение температуры. Следовательно, газ при этом отдает (холодильнику) количество теплоты Q34.
4. Четвертый процесс. При постоянном давлении p1 газ сжимается от объема V2 до объема V1 и совершает при этом отрицательную работу
А41=p1(V1–V2)=-p1(V2-V1).
Уменьшение объема при изобарном процессе связано с понижением температуры газа. Следовательно, здесь, как и в предыдущем случае, газ отдает (холодильнику) некоторое количество тепла Q41.
Теперь можно приступить к вычислению КПД цикла по формуле:
h=A/Q1=(Q1-Q2)/Q1=(T1-T2)/T1.
где A – работа, совершенная рабочим веществом в течение цикла;
Q1 – количество теплоты, полученное за это время рабочим веществом;
Q2 – количество теплоты, отданное при этом холодильнику;
T1 и T2 – наивысшая и наинизшая температуры рабочего вещества.
Работа газа совершается во втором и четвертом процессах и равна
A=A23+A41=(p2-p1)(V2-V1).
Количество теплоты Q, сообщенное газу при его нагревании, найдем на основании первого начала термодинамики. Учитывая, что газ получает теплоту в первом и втором процессах:
Q=DU+A.
Изменение внутренней энергии DU при переходе газа из состояния 1 в состояние 3 вычислим как разность значений U3 и U1:
DU=U3-U1=imR(T3-T1)/2m
На основании уравнения газового состояния, можно записать:
DU=i(p2V2-p1V1)/2.
Подставив вместо DU и A23 их значения в формулу для определения Q1, получим
Q1=i(p2V2-p1V1)/2+p2(V2-V1).
Наконец найдем КПД цикла
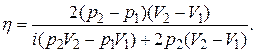
Подставив числовые значения величин p1, p2, V1, V2, из условия задачи и учитывая, что газ трехатомный и, следовательно, i=6, получим:
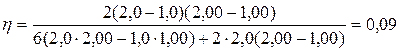 .
.
Чтобы определить наибольший КПД цикла, выразим количество теплоты, сообщенное газу, через молярные теплоемкости Cp и CV
Q=Q1+Q2=nCV(T2-T1)+nCp(T3-T2).
С помощью уравнения Менделеева–Клапейрона, записав его для каждого из трех состояний 1, 2, 3 преобразуем вышенаписанную формулу для Q1:
Q1=((p2–p1)V1CV/R)+((V2-V2)p2Cp/R).
Подставив значения A и Q1 в формулу для КПД, получим
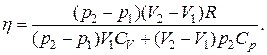
Чтобы упростить исследование, разделим числитель и знаменатель на произведение p2V2 и введем обозначения a=p1/p2, b=V1/V2:
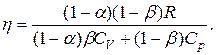
Заметим, что согласно условию каждая из величин a и b может принимать любые значения в интервале от 0 до 1.
При произвольном фиксированном значении b выражение приобретает вид:
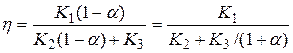 ,
,
где K1, K2, K3 – постоянные положительные величины.
Из полученного выражения видно, что h(a) – убывающая функция. Следовательно, она принимает наибольшее значение при a=0.
При любом фиксированном значении a имеем
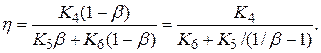
где К4, К5, К6 – постоянные положительные величины.
Из последнего выражения видно, что (b) – убывающая функция. Значит, ее наибольшему значению соответствует b=0.
Сопоставляя полученные результаты, приходим к выводу, что, положив в формуле для КПД a=0, b=0, найдем предельное значение hпред:
hпред=R/Cp=2/(i+2)=2/(6+2)=0,25.
Ответ: η=0,09; hпред=0,25.
Задача 10
Тепловая машина работает по циклу Карно, КПД которого h=0,25. Каков будет холодильный коэффициент h' машины, если она будет совершать тот же цикл в обратном направлении? Холодильным коэффициентом называется отношение количества теплоты, отнятого от охлаждаемого тела, к работе двигателя, приводящего в движение машину.
Решение. КПД любого цикла, в том числе и цикла Карно, можно определить по формуле
h=A/Q1=(Q1-Q2)/Q1.
Особенностью цикла Карно является его обратимость: процесс может протекать как в прямом, так и в обратном направлении. При обратном цикле Карно рабочее вещество будет, расширяясь по изотерме T2=const, отбирать от холодильника количество теплоты Q2 и, сжимаясь по изотерме T1=const, отдавать нагревателю количество теплоты Q1. При этом работа, совершенная рабочим веществом за один цикл, будет отрицательной (положительная работа расширения меньше по модулю отрицательной работы сжатия). В этом случае положительной будет работа A двигателя, приводящего в действие машину.
Согласно определению холодильного коэффициента, запишем
h'=Q2/A.
Чтобы его определить, исключим из формулы КПД цикла Карно величину Q1=A+Q2:
h=A/(A+Q2).
Выполнив преобразования, получим:
1/h=(A+Q2)/A=1+Q2/A=1+h'
или
h'=1/h-1.
Подставив численные значения, будем иметь
h'=1/0,25-1=3, или h'=300%.
Ответ: h'=3, или h'=300%.
Задача 11
Нагреватель тепловой машины, работающий по обратимому циклу Карно, имеет температуру t1=200 oС. Определить температуру T2 охладителя, если при получении от нагревателя количества теплоты Q1=1 Дж машина совершает работу A=0,4 Дж. Потери на трение и теплоотдачу не учитывать.
Решение. Температуру охладителя найдем, воспользовавшись выражением для термического КПД машины, работающей по циклу Карно:
h=(T1-T2)/T1.
Отсюда
T2=T1 (1-h).
Термический КПД тепловой машины выражает отношение количества теплоты, которое превращено в механическую работу A, к количеству теплоты Q1, которое получено рабочим телом тепловой машины из внешней среды (от нагревателя):
h=A/Q1.
Подставив это выражение, найдем
T2=T1(1-A/Q1).
Учтя, что Т1=473 К, после вычисления будем иметь
T2=473(1-0,4/1)=284 К.
Ответ: T2=284 К.
Задача 12
Струя водяного пара при температуре 100 oС, направленная на глыбу льда, имеющую массу m=5 кг и температуру 0 oС, растопила ее и нагрела получившуюся воду до температуры 50 oС. Найти массу израсходованного пара и изменение энтропии при описанных процессах.
Решение. Количество теплоты, необходимое для плавления льда и для нагревания полученной холодной воды, равно количеству теплоты, выделившейся при превращении пара в воду той же температуры и последующем охлаждении полученной горячей воды. Составим уравнение теплового баланса:
m1l+cm1(q-t1)=m2r+cm2×(t2-q),
где m1 – масса льда;
m2 – масса пара;
l – удельная теплота плавления льда;
r – удельная теплота парообразования воды;
с – удельная теплоемкость воды;
q – температура смеси;
t1 – температура плавления льда;
t2 –температура кипения воды.
Решая уравнение относительно m2, получаем
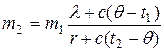 .
.
Подставим числовые значения величин в единицах СИ: l=3,35×105 Дж/кг, r=2,25×106 Дж/кг, c=4,19×103 Дж/(кг×град), m1=5 кг, произведем вычисление, будем иметь
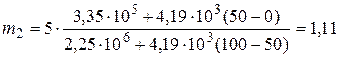 кг.
кг.
Изменение энтропии DS равно сумме изменений энтропии при таянии льда (DS1), при нагревании получившейся холодной воды (DS2), при превращении пара в воду той же температуры (DS3) и, наконец, при охлаждении полученной горячей воды до окончательной температуры смеси (DS4).
Изменение энтропии при переходе системы из состояния 1 в состояние 2 выражается формулой
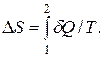
Найдем изменение энтропии при каждом из описанных процессов:
1) при таянии льда температура T сохраняет постоянное значение, равное 273 К. Вынося постоянную температуру за знак интеграла, получаем
DS=Q1/T,
где Q1=lm1 – количество теплоты, необходимое для таяния льда.
Следовательно,
DS1=lm1/T.
2) при нагревании воды на dT требуется количество теплоты, равное:
dQ2=cm1dT.
Следовательно, изменение энтропии при нагревании воды выразится так:
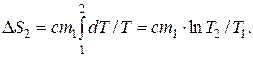
3) при превращении пара в воду той же температуры изменение энтропии может быть найдено на основании тех же соображений, что и в случае таяния льда, т.е.
DS3=Q/T=-rm2/T.
Изменению энтропии приписывается знак "минус", так как теплота выделяется.
4) наконец, изменение энтропии, происходящее при охлаждении полученной горячей воды, найдем на основании тех же рассуждений, что и в случае нагревания воды, т.е.
DS4=-cm2×lnT2/T1.
Знак "минус" – так как теплота отбирается.
Полное изменение энтропии рассмотренных процессов будет равно:
DS=DS1+DS2+DS3+DS4,
или
DS=lm1/T1+cm1×lnq/T1–rm2/T2–cm2×lnq/T2.
Подставляя численные значения величин в единицах СИ, произведем вычисление, имеем
DS=3,35×105×5/273+4,19×103×5×ln323/273–2,25×106×1,11/373-4,19×103×
×1,11×ln323/373=2,27×103 Дж/К.
Ответ: m2=1,11 кг; DS=2,27×103 Дж/К.
 2015-07-03
2015-07-03 2921
2921








