A.  В две пробирки налил по 3-5 капель раствора нитрата свинца (2) и прибавил в одну пробирку несколько капель йодида калия, в другую – хлорида бария. Получил:
В две пробирки налил по 3-5 капель раствора нитрата свинца (2) и прибавил в одну пробирку несколько капель йодида калия, в другую – хлорида бария. Получил:
 Pb(NO3)2 + 2KI = 2KNO3 + PbI2 (ярко-жёлтый осадок)
Pb(NO3)2 + 2KI = 2KNO3 + PbI2 (ярко-жёлтый осадок)
Pb2+ + 2NO3- + 2K+ + 2I- = 2K+ + 2NO3- + PbI2
 Pb2+ + 2I- = PbI2
Pb2+ + 2I- = PbI2
 Pb(NO3)2 + BaCl2 = Ba(NO3)2 + PbCl2(белыйосадок)
Pb(NO3)2 + BaCl2 = Ba(NO3)2 + PbCl2(белыйосадок)
 Pb2+ + 2NO3- + Ba2+ + 2Cl- = Ba2+ + 2NO3- + PbCl2
Pb2+ + 2NO3- + Ba2+ + 2Cl- = Ba2+ + 2NO3- + PbCl2
Pb2+ + 2Cl- = PbCl2
Ион металла 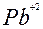 образует осадки с ионами хлора и йода. Присутствие иона
образует осадки с ионами хлора и йода. Присутствие иона
йода в составе соединения, дает ярко-желтую окраску иодида свинца.
B.  В одну пробирку налил 3-5 капель раствора сульфата натрия, в другую – столько же раствора сульфата хрома (3). В каждую пробирку добавил по несколько капель раствора хлорида бария до выпадения осадков. Получил:
В одну пробирку налил 3-5 капель раствора сульфата натрия, в другую – столько же раствора сульфата хрома (3). В каждую пробирку добавил по несколько капель раствора хлорида бария до выпадения осадков. Получил:
 Na2SO4 + BaCl2 = 2NaCl + BaSO4 (белыйосадок) NH3 + H2O
Na2SO4 + BaCl2 = 2NaCl + BaSO4 (белыйосадок) NH3 + H2O
 2Na+ + SO42- + Ba2+ + 2Cl- = 2Na+ + 2Cl- + BaSO4
2Na+ + SO42- + Ba2+ + 2Cl- = 2Na+ + 2Cl- + BaSO4
Ba2+ + SO42- = BaSO4
 |
 Cr2(SO4)3 + 3BaCl2 = 2CrCl3 + 3BaSO4(белыйосадок)
Cr2(SO4)3 + 3BaCl2 = 2CrCl3 + 3BaSO4(белыйосадок)
2Cr3+ + 3SO42- +3Ba2+ + 6l- = 2Cr3+ + 6Cl- + 3BaSO4

 Ba2+ + SO42- = 3BaSO4
Ba2+ + SO42- = 3BaSO4
В качестве осадка образуется нерастворимая соль – сульфат бария, имеющая белый цвет. Если с сульфатом натрия прореагирует сульфат железа(3), то в результате получатся железонатриевые квасцы. С сульфатом хрома сульфат железа (3) реагировать не будет.
|
|
|
Вывод: В результате двух реакций у меня получились 3 малорастворимые соли: хлорид свинца(2), йодид свинца(2) и сульфат бария. Полученные осадки, кроме йодида свинца имеют белый цвет, йодид свинца имеет ярко-желтый цвет.
 2015-07-21
2015-07-21 5670
5670








