Бактерии находятся в большом количестве на всех окружающих человека предметах, в воздухе, на поверхности тела, в содержимом внутренних органов и т. д. Стафилококковая инвазия, имевшая ведущее значение до середины 60-х годов, в настоящее время постепенно заменяется и теснится грамотрицательными бактериями (Klebsiella pneumoniae, Enterobacter cloaque, Serratia marcescens, Е. coil, Pseudomonasaeruginosa, Proteus species), грибами и вирусами. Источники, из которых патогенные бактерии проникают в рану, бывают экзогенными и эндогенными.
Экзогенной считается инфекция, попадающая в рану из внешней среды, окружающей больного: 1) из воздуха — воздушная инфекция; 2) с брызгами слюны и других жидкостей — капельная инфекция; 3) с предметов, соприкасающихся с раной — контактная инфекция; 4) с предметов, оставляемых в ране (швы, дренажи, металлические стержни и пластинки, искусственные клапаны сердца, синтетические протезы сосудов, электрокардиостимуляторы и т. д.) — имплантационная инфекция.
Воздух как средство передачи инфекции (патогенный стафилококк) играет важную роль, особенно в операционных, реанимационных отделениях и отделениях интенсивной терапии. Перенос патогенных микроорганизмов от больного к больному обозначается как перекрестная инфекция. С увеличением длительности пребывания больного в больнице эта опасность возрастает, поэтому необходимо добиваться, чтобы время предоперационного обследования и послеоперационного пребывания больного в стационаре было как можно меньше. Операционные отделения, помещения центральной стерилизационной, отделение интенсивной терапии, диагностические кабинеты, в которых возможен переход воздушной и капельной инфекции от больного к больному, от персонала и посетителей к больному и наоборот, душ и ванны следует рассматривать как зоны, нуждающиеся в особенно тщательном контроле.
|
|
|
Контактная и имплантационная инфекция в большинстве случаев связана с гнилостным распадом тканей, развитием септицемии и септического шока. Возбудители инфекции в большом количестве находятся в ротовой полости, кишечнике, выводных протоках сальных и потовых желез. К примеру, синегнойная палочка хорошо развивается в сырости, поэтому ее чаще всего обнаруживают в раковинах, ваннах, мочевых приемниках, на полотенцах, тряпках, в цветочных горшках. Клостридии (возбудители столбняка и газовой инфекции) обнаруживавются чаще всего в пыли и грязи. Существенное значение имеет дезинфекция матрацев, подушек, одеял; необходимо для каждого вновь поступившегобольного иметь продезинфицированные постельные принадлежности.
Эндогенной считается инфекция, находящаяся внутри организма или на его покровах. Эндогенная инфекция попадает в рану либо непосредственно, либо по сосудистым (лимфатическим или кровеносным) путям. Основными очагами эндогенной инфекции являются: 1) воспалительные процессы покровного эпителия (фурункулы, карбункулы, пиодермии, экземы и т. д.); 2) очаговая инфекция желудочно-кишечного тракта (кариес зубов, гингивиты, холециститы, холангиты, панкреатиты и т. д.); 3) инфекция дыхательных путей (гаймориты, фронтиты, трахеиты, бронхиты, воспаление легких, бронхоэктазы, абсцессы легких); 4) воспаления урогенитального тракта (пиелиты и циститы, простатиты, уретриты, сальпингоофориты); 5) очаги неизвестной (криптогенной) инфекции.
|
|
|
Иногда проникающие в организм патогенные микробы отграничиваются плотным соединительнотканным валом. Такая дремлющая или латентная инфекция вокруг инородных тел, паразитических червей (эхинококк) даже через много лет при понижении реактивности организма может резко обостриться.
1.3. Профилактика контактной и имплантационной инфекции. Стерилизация и дезинфекция.
ПРОФИЛАКТИКА КОНТАКТНОЙ И ИМПЛАНТАЦИОННОЙ ИНФЕКЦИИ. СТЕРИЛИЗАЦИЯ И ДЕЗИНФЕКЦИЯ
Стерилизация достигается с помощью физических и химических методов. К физическим методам относятся термическая и лучевая стерилизация (кипячением, стерилизация паром под давлением, сухожаровая стерилизация, гамма-облучение). Химические методы стерилизации включают в себя стерилизацию окисью этилена, обработку надуксусной кислотой, а также химиотерапевтическую обработку. Кроме того, для создания асептических условий в операционных или в изоляторах используют физиотерапию воздуха с целью очищения его от бактерий.
Наиболее надежными считаются термические способы стерилизации, лучевая стерилизация и стерилизация окисью этилена.
При термических способах стерилизация производится либо водяным паром в автоклаве при температуре 120—132С (рис. 1), либо сухим паром в сухожаровых стерилизаторах (шкаф) при температуре 170—200°С.

Рис. 1. П аровой стерилизатор высокого давления – автоклав.
Стерилизация паром. Горячий водяной пар служит переносчиком тепла. Он действует интенсивнее, чем горячий воздух, так как высокая теплоемкость пара при конденсации переносится на стерилизуемый объект. Одновременно пар действует как непосредственный стерилизующий агент путем гидратирования, коагуляции и гидролиза белков
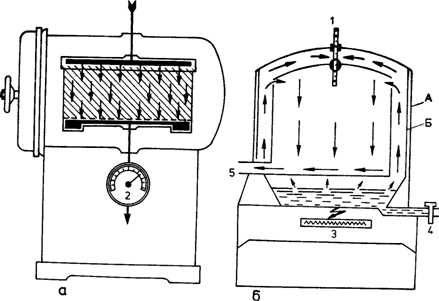
Рис. 16. Схемы (а, б) парового стерилизатора (автоклава):
А — наружная стенка стерилизатора; Б — внутренняя стенка стерилизатора; 1 — термометр; 2 — манометр; 3 — источник тепла; 4 — вводный кран; 5 — выпускной кран.
Аппарат для стерилизации паром под давлением (автоклав) состоит из двух металлических цилиндров разного диаметра, вставленных один в другой так, что между ними остается пространство, которое наполняется водой (рис. 16). Во внутреннюю камеру автоклава кладут стерилизационные коробки с фильтром, биксы перевязочного материала или пакеты с инструментами в двухслойной упаковке из бязи или в пергаментной бумаге. Плотно завинчивают боковую дверь парового стерилизатора и начинают стерилизацию в заданном режиме. Паровой стерилизатор оборудован термометром, манометром (указывает давление пара внутри аппарата) и предохранительным клапаном, который срабатывает при нарастании избыточного давления.
Автоклавирование проводится при давлении пара 1,1+0,1 кгс/см2
в течение 45+3 мин или 2,0 ±0,1 кгс/см2 в течение 20+2 мин.
Все предметы, которые не выдерживают высокой температуры жаровой стерилизации и для которых температура пара не является повреждающей, должны стерилизоваться автоклавированием (перевязочный материал, резиновые и синтетические предметы, бумажные фильтры, закрытые ампулы и банки с водосодержащими препаратами и др.).
|
|
|
По окончании стерилизации пар из аппарата удаляют через выпускной кран в воду и выводят в канализационный сток. Отвинчивают боковой люк, выпускают остаток пара и в течение некоторого времени проводят сушку материала теплом стенок стерилизатора.
Сухожаровая стерилизация. При сухожаровой стерилизации (рис. 17) происходит разогревание стерилизуемых объектов. Так как горячий воздух в отличие от водяного пара служит только переносчиком тепла, температура стерилизуемых предметов должна достигнуть 170—200°С (180±14°С) при экспозиции 60+5 мин. Термическое распределение обеспечивают за счет поступления нагретого воздуха через специальный клапан в нижней части воздушного стерилизатора, а его выход — через верхний клапан. При подъеме воздух отдает тепло стерилизуемым объектам.
Путем сухожаровой стерилизации можно обрабатывать все термостабильные, негорючие материалы из стекла, металла или фарфора. Сухожаровая стерилизация непригодна для перевязочного материала, резины, катетеров, изделий из бумаги и пластиков. Стерилизуемые объекты, например шприцы, закладывают чистыми и сухими в холодный аппарат (рис. 18). Добавление новых материалов и предметов для стерилизации недопустимо. После отключения воздушного стерилизатора необходимо дождаться снижения температуры до 80 °С. Подключенный к электросети стерилизатор нельзя открывать, так как поступление кислорода может привести к воспламенению. Несмотря на наличие автоматики и программированного управления, автоклавы и сухожаровые стерилизаторы недопустимо оставлять без присмотра персонала.
Лучевая стерилизация. Этот вид стерилизации осуществляется ионизирующим излучением большой энергетической мощности, проникающим в стерилизуемый материал на различную глубину. В практических целях применяются бета- и гамма-излучение. Для стерилизации гамма-излучением изотопами 60Со и 137Cs доза облучения должна быть весьма значительной — не менее 2,5 мрад (25000 Гр), чтобы исключить возможность оставления жизнеспособной Особенно удобна стерилизация гамма-излучением сывороток, вакцин, биологических тканей, лекарственных препаратов, медицинских изделий одноразового пользования (системы для переливания крови, атравматические иглы, трахеостомические канюли, электрокардиостимуляторы и т. п.). Существенным препятствием к широкому внедрению лучевого метода стерилизации является опасность проникающей радиации для людей. Это заставляет создавать громоздкую систему противолучевой защиты гамма-установок, что по силам только мощным специализированным учреждениям.
|
|
|
Возможна также стерилизация ультразвуком. Стерилизаторы наполняют слабым антисептиком (0,05% водный раствор хлоргексидина биглюконата), в котором под воздействием ультразвуковых волн стерилизуют хирургический инструментарий, мелкие пластмассовые изделия или производят дезинфекцию рук.
Химическая стерилизация. Увеличение числа приборов и устройств, которые трудно стерилизовать традиционными методами, способствовало появлению новых методов стерилизации. Под химической (холодной) понимают стерилизацию с помощью окиси этилена или сильнодействующих антисептиков (0,2% раствор надуксусной кислоты, 6% раствор перекиси водорода, 0,1%-терги-цида, 0,5% спиртовой раствор гибитана, сайдекс, тройной раствор и др.). Холодная стерилизация осуществляется в условиях, при которых температура не превышает температуры коагуляции белка (от 45 до 60 °С; рис. 19).
 Рис. 19. Камера для новой стерилизации пароформалиновой стерилизации
Рис. 19. Камера для новой стерилизации пароформалиновой стерилизации
Окись этилена, оказывающая бактерицидное действие за счет алкилирования протеинов бактерий, растворима в воде, спиртах. При нормальных атмосферных условиях это бесцветный газ с неприятным эфирподобным запахом.
Применяются портативные газовые стерилизаторы с полезным объемом 2—3 л (ГДР, ВНР). При температуре 55°С, концентрации окиси этилена 750—1000 мг/л и соответствующей влажности газа успешно используется управляемая программа стерилизации при небольшом избыточном давлении, что предотвращает улетучивание газа. Газовые стерилизаторы не требуют большого помещения, необходимо наладить лишь вентиляцию; после стерилизации оставшийся газ удаляют черезвыпускники камеры в вытяжные трубы.
С помощью газовой стерилизации следует обрабатывать лишь те предметы, которые не выдерживают стерилизацию в автоклаве или воздушном стерилизаторе. Окисью этилена стерилизуют катетеры из искусственных материалов, хирургические перчатки, протезы сосудов, эндоскопы, кардиостимуляторы, отдельные узлы респираторов и аппаратов искусственного кровообращения с выдержкой 6—16 ч. Изделия, простерилизованные газовым методом, применяют после выдержки в вентилируемом помещении в течение 1—5 сут.
Проверка качества стери л изации. Вещества и предметы считаются стерильными, если они в упакованном виде обработаны термическим путем или облучением и если эффект стерилизации подтвержден индикатором стерильности. Контроль работы воздушных и паровых стерилизаторов проводят с применением химических тест-индикаторов и с помощью максимальных термометров.
Показателями качества работы стерилизаторов являются:
изменение исходного состояния (цвет, агрегатное состояние) химических тест-индикаторов и отклонение температуры в различных точках камеры парового стерилизатора от номинального значения в пределах Т±2°С.
Контроль работы воздушных стерилизаторов осуществляется цветным термоиндикатором ТИК № 6 и гидрохиноном. Нанесенная на бумагу термоиндикаторная краска марки ТИК № 6 светло-салатового цвета при температуре 175—180°С становится темно-коричневой. Гидрохинон в количестве 0,3 г помещается в стеклянный флакон. При температуре 170—175°С серо-коричневый порошок гидрохинона превращается в расплавленную массу черного цвета.
Работу парового стерилизатора ежедневно контролируют тест-индикатором мочевины или бензойной кислоты с фуксином. При режиме стерилизации 132 °С и давлении в 2 ат белый порошок мочевины плавится, превращаясь в аморфную массу того же цвета (в биксы помещается флакончик с мочевиной в количестве 0,3 г). При режиме стерилизации 120 °С и давлении в 1,1 ат в качестве индикатора применяют бензойную кислоту с фуксином, фуксин выполняет роль красителя. При температуре, близкой к пару (120 °С), бензойная кислота с кислым фуксином расплавляются, превращаясь в аморфную массу красного цвета, а с основным фуксином — синего цвета. Применение серы для контроля эффективности стерилизации не рекомендуется.
Контроль за качеством стерилизации окисью этилена проводят с использованием индикоторов в виде раствора глицерола с этиленом (растворI ) и бромида лития, бромкрезолового пурпурного с этанолом (раствор II).
Помимо обязательного ежедневного контроля эффективности стерилизации в стерилизаторе пробой на достижение точки плавления раз в неделю (выборочно) или через 10 дней проводят бактериологический контроль материала. Бактериологический контроль является самым надежным методом контроля стерильности. Его недостатком является продолжительный период и трудоемкость исследования. В связи с этим в клинической практике широко используются перечисленные экспресс-методы.
 2015-08-13
2015-08-13 1073
1073








