Билет
1. Стандартные растворы, способы их приготовления. Примеры.
Стандартный раствор, титрованный раствор, раствор с точно известной концентрацией реактива химического. Стандартный раствор применяется в методах титриметрического анализа для установления количества определяемого вещества посредством титрования до точки эквивалентности, обычно фиксируемой по изменению окраски индикатора химического или титруемого раствора. Для расчетов результатов устанавливают количество (объём, иногда масса) стандартного раствора, затраченного на взаимодействие с определяемым веществом. Точность определений зависит от правильности установления концентрации стандартного раствора. Обычно её выражают нормальностью. Для практических целей пользуются также титром.
Виды стандартных растворов и способы их приготовления. Различают первичные и вторичные стандартные растворы. Стандартные растворы: 1. первичные (приготовленные)(из стандартного исходного вещества и из фиксанала) и 2. вторичные (установленные)(из кристаллического вещества и из более концентрированного раствора).
Первичный стандартный раствор можно приготовить сразу с точно известной концентрацией и не стандартизировать.
Способы приготовления первичных стандартных растворов: 1. Из кристаллического стандартного вещества (установочного вещества, исходного вещества, первичного стандарта). Взвешивают на аналитических весах точную навеску стандартного вещества, переносят в мерную колбу, растворяют в дистиллированной воде, затем доводят до метки. Ориентировочную массу навески вещества для приготовления раствора рассчитывают по формуле:
m(A) =C( A)*V(A)*M(
A)*V(A)*M( A) После взятия навески и ее растворения в мерной колбе рассчитывают точную концентрацию приготовленного раствора по формуле:
A) После взятия навески и ее растворения в мерной колбе рассчитывают точную концентрацию приготовленного раствора по формуле:
C( A)=
A)=  Например, надо приготовить 100 мл 0,1 н. Na2B4O7 (fэкв.=1/2) из кристаллического препарата Na2B4O7 ∙ 10Н2О. Рассчитали ориентировочную массу навески:
Например, надо приготовить 100 мл 0,1 н. Na2B4O7 (fэкв.=1/2) из кристаллического препарата Na2B4O7 ∙ 10Н2О. Рассчитали ориентировочную массу навески:
m(Na2B4O7 ∙ 10Н2О)=C( Na2B4O7) * V(Na2B4O7)*M(
Na2B4O7) * V(Na2B4O7)*M( Na2B4O7∙ 10Н2О)= 0,1* 0,1 *190,686 =1,9069г. Затем провели взятие навески на аналитических весах: m(Na2B4O7∙ 10Н2О)= 1,9371г.
Na2B4O7∙ 10Н2О)= 0,1* 0,1 *190,686 =1,9069г. Затем провели взятие навески на аналитических весах: m(Na2B4O7∙ 10Н2О)= 1,9371г.
перенесли ее в мерную колбу вместимостью 100,0 мл, растворили и довели дистиллированной водой до метки. Рассчитаем точную концентрацию полученного первичного стандартного раствора:
C( Na2B4O7) =
Na2B4O7) =  =0,1016 моль/л.
=0,1016 моль/л.
2. Из фиксанала (стандарт-титра). Фиксанал – это точно отвешенная масса твердого вещества квалификации «х. ч.» или точно отмеренный объем его раствора, помещенные в запаянные стеклянные ампулы. Содержимое ампулы переносят через воронку в мерную колбу, разбивая бойком, разбавляют до метки и получают раствор с точно известной концентрацией.Применение фиксаналов значительно сокращает время на приготовление стандартных растворов.
Поскольку чаще всего в ампуле содержится 0,1 моль-экв вещества, то концентрацию стан- дартного раствора, приготовленного из фикса- нала в мерной колбе вместимостью V, находят по формуле: C(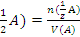 =
= 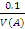
Вторичный стандартный раствор готовят в два этапа. 1. Готовят раствор с примерно известной концентрацией из кристаллического вещества или из более концентрированного раствора, используя технические весы и мерную посуду с ориентировочными делениями (мерные цилиндры, стаканы с делениями). 2. Определяют его точную концентрацию (стандартизируют) путем титрования первичного стандартного раствора. Например, рабочие растворы HCl и NaOH можно приготовить как вторичные стандарты путем разбавления более концентрированных растворов с последующей стандартизацией по первичным стандартным растворам тетрабората натрия Na2B4O7 ∙ 10H2O и щавелевой кислоты Н2С2O4 × 2H2O. Концентрацию растворов установочных веществ задают близкой к концентрации рабочих растворов.
2. Объективные ошибки фотометрии, рассмотреть на примере зависимости А от t°, С, τ, РН – среды.
Источниками ошибок при фотометрировании могут быть отклонения от закона Бугера- Ламберта - Бера и особенности возникающей окраски.
. Реакцию переведения определяемого иона в окрашенное соединение можно представить уравнением: Х + R* ХR
где X - определяемый ион в большинстве случаев бесцветный или слабоокрашенный; - реагент, окрашенный иначе, чем соединение ХR;
ХВ - окрашенное соединение.
· Например, ион железа (III) слабожелтый, ион роданида бесцветный, а роданидный комплекс железа ярко-красный. Характер светопоглощения при образовании комплекса может сильно изменяться, примером такого изменения могут служить спектрофотометрические кривые.
Интенсивность окраски раствора, зависящая от соотношения концентраций окрашенных и бесцветных частиц, изменяется с изменением общей концентрации раствора, так как при этом происходит одновременное изменение степени диссоциации. В результате при разбавлении или при концентрировании растворов наблюдаются отклонения от основного закона фотометрии.
· Большинство окрашенных соединений чувствительно к концентрации ионов водорода. При изменении рН раствора происходит изменение молярного коэффициента поглощения, а очень часто изменение и кривой светопоглощения.
· У большинства окрашенных соединений интенсивность окраски изменяется со временем. В общем случае вначале происходит постепенное возрастание оптической плотности, так как реакции образования окрашенных соединений идут во времени. Затем на определенный интервал времени окраска стабилизируется и именно этот период используется в фотометрическом анализе. Затем наступает явление «выцветания» окраски - уменьшение оптической плотности, связанное с действием кислорода воздуха, солнечного света и других факторов. В некоторых случаях, например для купфероната ванадия, период созревания окраски очень мал и она стабильна в течение 30-40 мин. Окраска фос-форомолибденового комплекса, наоборот, медленно созревает, в течение 40-60 мин, а затем очень долгое время остается стабильной. Поэтому всегда при фотометрических исследованиях необходимо предварительными опытами установить интервал времени стабильности исследуемого окрашенного соединения.
3. Полярные и неполярные молекулы.Факторы, определяющие полярность молекулы.
Молекулы, которые образованы атомами разных элементов, могут быть полярными и неполярными. Это зависит от геометрической формы.
Если форма симметрична, то молекула неполярна (BeH2, BF3, CH4, CO2, SO3), если асимметрична (из-за наличия неподелённых пар или неспаренных электронов), то молекула полярна (NH3, H2O, SO2, NO2).
При замене одного из боковых атомов в симметричной молекуле на атом другого элемента также происходит искажение геометрической формы и появление полярности, например в хлорпроизводных метана CH3Cl, CH2Cl2 и CHCl3(молекулы метана CH4 неполярны).
Полярность несимметричной по форме молекулы вытекает из полярности ковалентных связей между атомами элементов с разной электроотрицательностью.
Как отмечалось выше, происходит частичный сдвиг электронной плотности вдоль оси связи к атому более электроотрицательного элемента, например:
| Hδ+ → Clδ− | Bδ+ → Fδ− |
| Cδ− ← Hδ+ | Nδ− ← Hδ+ |
(здесь δ - частичный электрический заряд на атомах).
Чем больше разность электроотрицательностей элементов, тем выше абсолютное значение заряда δ и тем более полярной будет ковалентная связь.
На полярность молекулы влияет величина дипольного момента, ориентация молекулы и ее деформация.
4. Особенности коллоидных ПАВ.Солюбилизация.
Коллоидными ПАВ называют поверхностно-активные вещества, способные в растворах образовывать мицеллы, т.е. ассоциаты, состоящие из большого количества молекул ПАВ (от 20 до 100).
Главная отличительная особенность этих веществ - способность образовывать термодинамически устойчивые (лиофильные) гетерогенные дисперсные системы. Основные свойства коллоидных ПАВ: высокая поверхностная активность, способность к самопроизвольному мицеллообразованию, способность к солюбилизации - (резкому увеличению растворимости веществ в растворах коллоидных ПАВ вследствии их внедрения вглубь мицеллы), высокая способность стабилизировать дисперсные системы.
Высокая поверхностная активность зависит от длины углеводородного радикала. Увеличение длины на одну группу СН2 приводит к возрастанию поверхностной активности в 3,2 раза (правило Дюкло-Траубе). Это правило соблюдается в основном для истинно растворимых ПАВ. Для органических сред это правило обращается, то есть с увеличением длины у/в радикала поверхностная активность уменьшается.
Билет
Иодометрия. Рабочие растворы, установочные вещества, индикаторы, условия титрования метода.
Иодометрия — титриметрический (объёмный) метод определения веществ, основанный на реакциях окисления-восстановления (разновидность оксидиметрии) с участием иода или иодида калия.
 2018-01-21
2018-01-21 5246
5246







