Таблиця 1. Якісні реакції на деякі катіони та аніони
| № п/п | Йон, який виявляємо | Реагент | Аналітичний ефект | Йонне рівняння реакції | |
 NH NH 
| NаОН | Виділення аміаку NH3 | NH4+ + ОН- = NH3↑ + H2O | ||
| К+ | Солі калію забарвлюють полум’я в бузковий колір | ||||
| Na+ | Солі натрію забарвлюють полум’я в жовтий колір | ||||
| Са2+ | Солі кальцію забарвлюють полум’я в цегляно-червоний колір | ||||
СO 
| Випадає білий осад | Ca2+ СO  = CaCO3↓ = CaCO3↓
| |||
| Ва2+ | Солі барію забарвлюють полум’я в жовто-зелений колір | ||||
SO 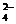 
| Випадає білий кристалічний осад, нерозчинний ні у воді, ні у кислотах | Ва2+ + SO 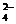  = ВаSO4 ↓ = ВаSO4 ↓
| |||
| Mg2+ | NаОН | Випадає білий аморфний осад | Mg2+ + 2OH- = Mg(OH)2 | ||
| Fe2+ | K3[Fe(CN)6] | випадає осад синього кольору (турнбулева синь) | 3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2 ↓ | ||
| ОН- | Випадає осад блідо-зеленого кольору, який на повітрі швидко буріє | Fe 2+ + 2OH- = Fe(OH)2↓ | |||
| Fe3+ | K4[Fe(CN)6] | випадає осад синього кольору – берлінська лазур | 4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]3 ↓ | ||
| CNS- | розчин забарвлюється в темно-червоний колір | Fe3+ + 3CNS- = Fe(CNS)3 | |||
| Pb2+ | S2- | Випадання чорного осаду | Pb + S = PbS↓ | ||
| Zn2+ | ОН- | Випадає білий осад, розчинний в надлишку лугу | Zn 2+ + 2OH- = Zn(OH)2↓ | ||
| Al3+ | ОН- | Випадає білий осад, розчинний в надлишку лугу | Al 3+ + 3OH- = Al(OH)3↓ | ||
NO 
| H2SO4 в присутності Cu при нагріванні | Поява бурого газу | 2 NO  + 8H+ + 3Cu0 = Cu2+ +2NO↑ + 2H2O,
2NО + O2 = 2NO2 + 8H+ + 3Cu0 = Cu2+ +2NO↑ + 2H2O,
2NО + O2 = 2NO2
| ||
SO 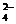 
| Ва2+ | Випадає білий осад, нерозчинний ні у воді, ні в кислотах | Ва2+ + SO 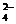 = ВаSO4 ↓ = ВаSO4 ↓
| ||
SO 
| Ва2+ | Утворюється білий осад, розчинний в кислотах | Ва2+ + SO  = ВаSO3 ↓ = ВаSO3 ↓
| ||
СO 
| Сильні мінеральні кислоти | Виділяється вуглекислий газ, який не підтримує горіння і виявляється за помутнінням вапняної води | СO  + H+ = СО2 + H2O;
СO2 + Ca2+ +2OH- = CaCO3↓ + H2O + H+ = СО2 + H2O;
СO2 + Ca2+ +2OH- = CaCO3↓ + H2O
| ||
| S2- | Ag+ | Випадає чорний осад | S2- + 2Ag+ = Ag2S↓ | ||
РО 
| Ag+ | Випадає жовтий осад, розчинний в надлишку нітратної кислоти | 2Ag+ + РО  = Ag3РО4↓ = Ag3РО4↓
| ||
| Cl- | Ag+ | Випадає білий сирнистий осад | Ag+ + Cl- = AgCl↓ | ||
| Br - | Ag+ | Випадання блідо-жовтий осад | Ag+ + Br - = AgBr↓ | ||
| J- | Ag+ | Випадання жовтого осаду | Ag+ + J- = AgJ↓ | ||
| Хлорна вода | Поява характерного коричневого кольору | Cl2 + 2J- = J2 + 2Cl- | |||
| Крохмаль | Поява синього забарвлення | ||||
SіO 
| Сильні мінеральні кислоти | Запустіння розчину – випадає осад силікатної кислоти | SіO  + 2Н+ = Н2SіO3↓ + 2Н+ = Н2SіO3↓
| ||
Якщо наявність речовини можна встановити якісною реакцією на один з йонів, то для визначення якісного складу речовини визначають присутність всіх йонів даної речовини.
|
|
|
КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
|
|
|
1. Що називають якісними реакціями?
2. Що таке реагент? Наведіть приклади реагентів.
3. Що таке аналітичний ефект?
4. Як встановити якісний склад речовини?
5. Запропонуйте реакції для встановлення якісного складу кухонної солі, харчової соди, аміачної селітри, мідного купоросу.
6. Як можна розпізнати йони в суміші йонів?
7. Запропонуйте план досліду для виявлення якісного складу бордоської суміші (інсектицид, що застосовується в сільському господарстві).
ЛІТЕРАТУРА
Сухан В.В., Табенська Т.В. та ін. Хімія: Посібник для вступників до вузів. Київ: Либідь, 1996 рік – стор. 201 – 271.
ВИКОНАННЯ РОБОТИ
ЗАВДАННЯ 1.
Встановіть якісний склад:
а) хлориду амонію;
б) купрум (ІІ) сульфату;
в) амоній карбонату;
г) ферум (ІІІ) хлориду.
Складіть план досліду. Напишіть рівняння реакцій в молекулярному, йонно-молекулярному та йонному вигляді. Зазначте ознаки кожної реакції.
ВИСНОВОК: Відмітьте, які якісні реакції лягли в основу встановлення катіонного та аніонного складу даної речовини.
ЗАВДАННЯ 2.
Встановити, в якій із пронумерованих пробірок знаходиться розчин натрій гідрокарбонату, аргентум нітрату, натрій ортофосфату.
Складіть план досліду, запишіть рівняння відповідних реакцій в молекулярному, йонно-молекулярному та йонному вигляді, запишіть ознаки реакцій. Зробіть висновок про те, в якій пробірці який розчин знаходився.
 2018-01-21
2018-01-21 947
947








