МЕТА: Закріпити знання про метали, їх властивості а також властивості їх сполук. Уточнити уявлення про якісні реакції, аналітичний ефект, реагенти. Вчити розв’язувати якісні завдання, ілюструвати свої міркування відповідними рівняннями реакцій.
ТЕОРЕТИЧНА ЧАСТИНА
Сутність якісних реакцій полягає у переведенні йона у хімічну сполуку з характерними властивостями. Аналітичний ефект – це видимі зміни, які супроводжують перебіг якісних реакцій. Хімічні реакції, які супроводжуються появою характерних ознак, називаються аналітичними. Речовина, яка викликає аналітичний ефект, називається реагентом.
Переважно у складі хімічних сполук типові метали перебувають у вигляді катіонів. Проте частина елементів з переважанням металічних властивостей за певних умов може входити до складу аніонів. Деякі характерні реакції на катіони представлені у таблиці 1 лабораторної роботи №4.
Взаємозв’язок між основними класами неорганічних сполук показаний у схемі:
МЕТАЛ ↔ ОСНОВНИЙ ОКСИД ↔ ОСНОВА
|
|
|
+ + + →СІЛЬ
НЕМЕТАЛ ↔ КИСЛОТНИЙ ОКСИД ↔ КИСЛОТА
ЛІТЕРАТУРА
Сухан В.В., Табенська Т.В. та ін. Хімія: Посібник для вступників до вузів. Київ: Либідь, 1996 рік – стор. 201 – 271.
ВИКОНАННЯ РОБОТИ
ЗАВДАННЯ 1.
1. Виходячи із заліза, добудьте осад ферум (ІІ) гідроксиду.
2. Виходячи з міді, добудьте осад купрум (ІІ) гідроксиду.
3. Виходячи з алюмінію, добудьте осад алюміній гідроксиду.
4. Виходячи з цинку, добудьте осад цинк гідроксиду.
Складіть план досліду, вкажіть перелік реактивів, потрібних для його проведення, запишіть відповідні рівняння реакцій в молекулярному вигляді. Перше рівняння урівняйте МЕБ, для другого складіть йонно-молекулярне та йонне.
ЗАВДАННЯ 2.
1. У трьох пронумерованих пробірках містяться розчини барій хлориду, цинк алюміній хлориду, кальцій хлориду. За допомогою яких реакцій можна розпізнати кожну речовину? Складіть план досліду, передбачте спостереження, запишіть рівняння відповідних реакцій в молекулярному, йонно-молекулярному, йодному вигляді.
2. У трьох пронумерованих пробірках містяться розчини ферум (ІІ) сульфату, алюміній сульфату, ферум (ІІІ) сульфату. За допомогою яких реакцій можна розпізнати кожну речовину? Складіть план досліду, передбачте спостереження, запишіть рівняння відповідних реакцій в молекулярному, йонно-молекулярному, йодному вигляді.
3. У трьох пронумерованих пробірках містяться розчини магній хлориду, цинк хлориду, ферум (ІІІ) хлориду. За допомогою яких реакцій можна розпізнати кожну речовину? Складіть план досліду, передбачте спостереження, запишіть рівняння відповідних реакцій в молекулярному, йонно-молекулярному, йодному вигляді.
|
|
|
4. У трьох пронумерованих пробірках містяться розчини магній нітрату, алюміній нітрату, барій нітрату. За допомогою яких реакцій можна розпізнати кожну речовину? Складіть план досліду, передбачте спостереження, запишіть рівняння відповідних реакцій в молекулярному, йонно-молекулярному, йодному вигляді.
ЗАВДАННЯ 3.
1. Виходячи з ферум (ІІ) сульфату добудьте ферум (ІІІ) оксид. Складіть план досліду, передбачте спостереження, запишіть рівняння відповідних реакцій в молекулярному, йонно-молекулярному, йодному вигляді.
2. Виходячи з алюміній хлориду добудьте натрій металюмінат. Складіть план досліду, передбачте спостереження, запишіть рівняння відповідних реакцій в молекулярному, йонно-молекулярному, йодному вигляді.
3. Виходячи з ферум (ІІ) хлориду добудьте ферум (ІІІ) оксид. Складіть план досліду, передбачте спостереження, запишіть рівняння відповідних реакцій в молекулярному, йонно-молекулярному, йодному вигляді.
4. Виходячи з цинк нітрату добудьте калій цинкат. Складіть план досліду, передбачте спостереження, запишіть рівняння відповідних реакцій в молекулярному, йонно-молекулярному, йодному вигляді.
ЛАБОРАТОРНА РОБОТА №7
ТЕМА: ХІМІЧНІ ВЛАСТИВОСТІ ОКСИГЕНОВМІСНИХ СПОЛУК
МЕТА: Уточнити та систематизувати знання про особливості оксигеновмісних сполук, вплив функціональних груп на їх реакційну здатність, про якісні реакції на основні класи оксигеновмісних сполук. Закріплювати вміння підтверджувати властивості вивчених речовин відповідними рівняннями реакцій.
ТЕОРЕТИЧНА ЧАСТИНА
При розв’язування експериментальних задач на розпізнавання органічних речовин необхідно враховувати, що досліджувана речовина може містити в своєму складі функціональну групу (-ОН, -СНО, -СООН тощо), кратні зв’язки (-С=С-, -С≡С-), або функціональну групу і кратні зв’язки одночасно. В цьому випадку підбирають реагент, на відповідну функціональну групу та передбачають той чи інший аналітичний ефект реакції (див. лаб. роб. №5). За наявністю чи відсутністю очікуваної ознаки роблять висновок про присутність заданої речовини.
Якщо необхідно розпізнати речовини з однаковими функціональними групами, то потрібно виявити ознаки, за якими вони відрізняються. Наприклад, акролеїн (2-пропеналь) СН2=СН-СНО і оцтовий альдегід (етаналь) СН3-СНО подібні за наявністю альдегідної групи, проте відмінні своїми радикалами: акролеїн містить ненасичений радикал, етаналь – насичений. Тому для їх розпізнавання варто використати реакцію на кратні зв’язки.
Слід відмітити, що в органічній хімії широко використовуються проби на полум’я: реакція Бельштейна, горіння ненасичених та насичених вуглеводнів тощо.
Необхідні якісні реакції на деякі органічні речовини та функціональні групи і зв’язки подані в таблиці.
Якісні реакції на деякі органічні сполуки
| № п/п | Речовина | Аналітичний ефект | Рівняння реакції |
| Алкани | За нормальних умов у хімічні реакції не вступають | ||
| Алкени | Знебарвлення розчину калій перманганату | 3СН2 = СН2 + 2 КмnO4 + 4H2O → 3CH2OH – CH2OH + 2 MnO2 + 2KOH | |
| Знебарвлення бромної води | СН2 = СН2 + Br2 → CH2OH – CH2OH | ||
| Алкіни | Знебарвлення розчину калій перманганату | 3CH ≡ CH + 8 KMnO4 + 4 H2O → 8MnO2 + 8KOH + HOOC – COOH | |
| Знебарвлення бромної води | CH ≡ CH + Br2 → CHBr2 – CHBr2 | ||
| Бензен | Утворення нітробензену (з'являється запах гіркого мигдалю) |
C6H6 + HNO3 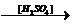 C6H5NO2 + + H2O C6H5NO2 + + H2O
| |
| Гліцерол | Утворення синього розчину в реакції із свіжоосадженим розчином купрум (ІІ) гідроксиду | ||
| Фенол | Утворення білого осаду в реакції з бромною водою | C6H5OH + 3Br2 → C6H2Br3OH + 3HBr | |
| Поява темно-фіолетового забарвлення в реакції з ферум (ІІІ) хлоридом | |||
| Альдегіди | Утворення червоного осаду в реакції з купрум (ІІ) гідроксидом (при нагріванні) |
R – COH + 2Cu(OH)2 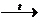 R – COOH + Cu2O↓ + 2H2O
R – COOH + Cu2O↓ + 2H2O
| |
| Утворення “срібного дзеркала” в реакції з аміачним розчином аргентум (І) оксиду | R – COH + Ag2O → R – COOH + 2Ag↓ | ||
| Карбонові кислоти | Змінюють забарвлення індикаторів | ||
| Метанова кислота | Утворення “срібного дзеркала” в реакції з аміачним розчином аргентум (І) оксиду | HCOOH + Ag2O → CO2↑+ H2O + + 2Ag↓ | |
| Глюкоза | Проба на альдегідну групу: утворення червоного осаду в реакції з купрум (ІІ) гідроксидом (при нагріванні) |
C5H11O5 – COH + 2Cu(OH)2 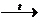 C5H11O5 – COOH + Cu2O + 2H2O
C5H11O5 – COOH + Cu2O + 2H2O
| |
| Проба на альдегідну групу: утворення “срібного дзеркала” в реакції з аміачним розчином аргентум (І) оксиду | C5H11O5 – COH + Ag2O → C5H11O5 – COH + 2Ag↓ | ||
| Проба на гідроксильні групи: утворення синього розчину в реакції із свіжоосадженим розчином купрум (ІІ) гідроксиду | |||
| Крохмаль | Поява синього забарвлення в реакції з йодом | ||
| Анілін | Утворення білого осаду в реакції з бромною водою | C6H5NH2 + 3Br2 → C6H2Br3NH2↓+ 3HBr | |
| Білки (кольорові реакції) | Біуретова реакція – поява фіолетового забарвлення в реакції з купрум (ІІ) гідроксидом | ||
| Ксантопротеїнова реакція – поява жовтого забарвлення в реакції з концентрованою нітратною кислотою |
|
|
|
КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
1. Що називають якісними реакціями?
2. Що таке функціональні групи? Наведіть приклади функціональних груп вивчених сполук.
3. Що таке реагент? Наведіть приклади реагентів.
4. Що таке аналітичний ефект?
5. Наведіть приклади якісних реакцій на відомі вам функціональні групи оксигеновмісних органічних сполук, вкажіть умови проходження реакцій та їх аналітичний ефект.
6. Як за допомогою одного реактиву визначити гліцерол та альдегід? Напишіть рівняння відповідних реакцій.
7. Доведіть за допомогою досліду, що в пронумерованих пробірках містяться гліцерол, фенол, олеїнова кислота. Складіть перелік реактивів та обладнання, необхідних для виконання досліду, напишіть рівняння відповідних реакцій.
|
|
|
8. Доведіть за допомогою дослідів, що оцтова кислота – слабка. Складіть перелік реактивів та обладнання, необхідних для виконання досліду, напишіть рівняння відповідних реакцій.
9. Як хімічним шляхом відрізнити машинне масло та олію? Складіть план досліду, перелік реактивів та обладнання, необхідних для виконання досліду, напишіть рівняння відповідних реакцій.
ЛІТЕРАТУРА:
Сухан В.В., Табенська Т.В. та ін. Хімія: Посібник для вступників до вузів. Київ: Либідь, 1996 рік – стор. 350 - 420.
ВИКОНАННЯ РОБОТИ
ДОСЛІД 1. ВЛАСТИВОСТІ СПИРТІВ
а) Фізичні властивості.
Налийте в пробірку 0,5 мл етилового спирту. Опишіть зовнішній вигляд речовини. Випробуйте спирт на запах. Підфарбуйте спирт чорнилом і обережно, по скляній паличці вилийте його у пробірку з водою. Спостерігайте, як спирт збирається шаром над водою. Скляною паличкою енергійно перемішайте рідини. Спостерігайте зменшення об’єму рідини і рівномірний розподіл забарвлення. Про що це свідчить?
В другу пробірку налийте до 1/3 об’єму води і додайте близько 1 мл гліцеролу. Спостерігайте лінію розподілу рідин. Про що це свідчить?
б) Взаємодія спиртів з металічним натрієм.
Налийте у фарфорову чашку 0,5 мл етилового спирту, до якого додайте шматочок металічного натрію розміром з сірникову головку.
Спостерігайте інтенсивне виділення газу.
Аналогічно проробіть дослід з розчином гліцеролу. Спостерігайте ще більш інтенсивне виділення газу. Напишіть рівняння відповідних реакцій.
в) Якісна реакція на багатоатомні спирти.
Добудьте осад купрум (ІІ) гідроксиду реакцією між купрум (ІІ) сульфатом та натрій гідроксидом.
Напишіть рівняння відповідної реакції.
До одержаного осаду додайте розчин гліцеролу, одержаний в першій частині досліду. Енергійно струшуйте пробіркою. Спостерігайте зникнення осаду та появу синього забарвлення розчину.
Напишіть схему хімічної реакції купрум (ІІ) гідроксиду та гліцеролу.
ВИСНОВОК: Вкажіть класифікаційну групу, до якої входять етанол та гліцерол, та властивості, які виявили в процесі дослідження. Що є якісним реактивом на багатоатомні спирти та яка ознака цієї реакції?
ДОСЛІД 2. ВЛАСТИВОСТІ ФЕНОЛУ.
а) Фізичні властивості.
Опишіть зовнішній вигляд речовини, обережно випробуйте на запах та спробуйте розчинити в холодній дистильованій воді. Що спостерігаєте? Одержану суспензію нагрійте в полум'ї спиртівки. Чому розчин став прозорим?
б) Взаємодія фенолу з лугами.
В пробірку покладіть кілька кристалів фенолу і налийте 2 мл розчину натрій гідроксиду. Енергійно струсіть пробірку. Спостерігайте зникнення кристалів.
Напишіть рівняння реакції і назвіть органічний продукт реакції.
в) Взаємодія з бромною водою.
До 0,25 мл фенолу додайте надлишок бромної води. Спостерігайте утворення білого осаду. Напишіть рівняння відповідної реакції і назвіть органічний продукт реакції.
г) Якісна реакція на фенол.
До розчину фенолу додайте кілька краплин ферум (ІІІ) хлориду. Спостерігайте появу фіолетового забарвлення ферум (ІІІ) феноляту.
Напишіть рівняння відповідної реакції.
ВИСНОВОК: Вкажіть властивості фенолу, які виявили в процесі дослідження. Що є якісним реактивом на феноли?
ДОСЛІД 3. РЕАКЦІЇ ОКИСНЕННЯ ОЦТОВОГО АЛЬДЕГІДУ.
а) Реакція „срібного дзеркала”.
Приготуйте аміачний розчин аргентум (І) оксиду взаємодією між нітратом срібла та надлишком амоній гідроксиду. Напишіть рівняння реакції.
До одержаного реактиву долийте розчин етаналю і суміш обережно нагрійте в полум'ї спиртівки. Спостерігайте появу характерного нальоту на стінках пробірки.
Напишіть рівняння реакції, зазначте умови протікання та назвіть продукти.
б) Окиснення етаналю свіжоприготованим осадом купрум (ІІ) гідроксиду.
До розчину купрум (ІІ) сульфату долийте розчин натрій гідроксиду. Напишіть рівняння реакції.
До добутого осаду долийте розчин альдегіду і вміст пробірки обережно нагрійте в полум'ї спиртівки. Спостерігайте появу оранжевого забарвлення. Напишіть рівняння реакції, назвіть її продукти.
ВИСНОВОК: У висновку зазначте, які властивості етаналю ви спостерігали. Що є якісним реактивом на альдегідну групу?
ДОСЛІД 4. ВЛАСТИВОСТІ ОЦТОВОЇ КИСЛОТИ.
а) У пробірку налийте 2-3 мл розчину оцтової кислоти і випробуйте її індикатором. Що спостерігаєте? Які висновки можна зробити із зміни забарвлення індикатора? Напишіть рівняння реакції дисоціації оцтової кислоти.
б) Взаємодія з металами.
Змочіть магнієву стрічку розчином оцтової кислоти. Спостерігайте виділення газу з поверхні магнію. Напишіть рівняння відповідної реакції. Назвіть продукти реакції.
в) Взаємодія з оксидами металів.
До 0,5 г порошку купрум (ІІ) оксиду додайте 2 мл розчину оцтової кислоти і нагрійте суміш до кипіння. Спостерігайте розчинення порошку купрум (ІІ) оксиду і появу блакитного забарвлення розчину. Напишіть рівняння реакції та назвіть її продукти.
г) Взаємодія з основами.
До зафарбованого фенолфталеїном розчину натрій гідроксиду долийте оцтової кислоти. Спостерігайте знебарвлення розчину. Напишіть рівняння реакції. Назвіть її продукти.
д) Взаємодія з солями.
У пробірку покладіть шматочок крейди і долийте розчин оцтової кислоти. Спостерігайте бурхливе виділення газу. Напишіть рівняння реакції та назвіть її продукти.
ВИСНОВОК: У висновку перелічіть загальнокислотні властивості оцтової кислоти, що їх ви спостерігали в ході виконання досліду.
ДОСЛІД 5. ДОБУВАННЯ ЕСТЕРІВ
Приготуйте суміш етанолу, оцтової кислоти та концентрованої сульфатної кислоти у співвідношенні 1: 1: 0,2. Два мілілітри цієї суміші помістіть у пробірку із зворотнім холодильником і вміст пробірки обережно нагрівайте на слабкому полум’ї спиртівки. В момент появи лінії розділення рідин припиніть нагрівання.
Вміст пробірки вилийте у склянку з концентрованим розчином натрій хлориду і дайте відстоятись рідині. За допомогою ділильної лійки відділіть естер і промийте його дистильованою водою. Опишіть спостереження, підтвердіть їх рівняннями відповідних реакцій.
ВИСНОВОК: У висновку зазначте, внаслідок якої реакції одержують естери у лабораторії та завдяки яким властивостям їх відділяють від реагуючої суміші.
ДОСЛІД 6. ВИЯВЛЕННЯ КРАТНИХ ЗВ’ЯЗКІВ У МОЛЕКУЛІ РІДКОГО ЖИРУ
До олії (триолеїну) додайте 1 мл бромної води і пробірку струсіть. Після відстоювання рідини спостерігайте, що олія збирається на поверхні води, а знебарвлена вода – в нижній частині пробірки. Спостереження підтвердіть рівнянням реакції.
ВИСНОВОК:У висновку зазначте, яка реакція дозволяє виявляти кратні зв’язки у молекулах оксигеновмісних сполук.
 2018-01-21
2018-01-21 2660
2660








