Сумма кинетических энергий хаотического движения всех частиц тела относительно центра масс тела (молекул, атомов) и потенциальных энергий их взаимодействия друг с другом называется внутренней энергией.
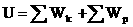
Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема.
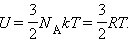
|
МКТ приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др.), молекулы которого совершают только поступательное движение:
| U = U (T, V). |
Кинетическая энергия частиц определяется скоростью, а значит - температурой тела.
Потенциальная - расстоянием между частицами, а значит - объемом.
Следовательно: U=U (T, V) - внутренняя энергия зависит от объема и температуры.
Внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела (Является функцией состояния).
Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную).
При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна.
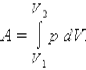
|
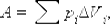
при Δ Vi → 0
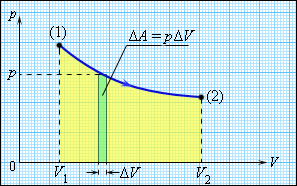 Работа при расширении.
Работа при расширении.
Работа численно равна площади под графиком процесса на диаграмме (p, V).
Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное.
Три различных пути перехода из состояния (1) в состояние (2). Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса 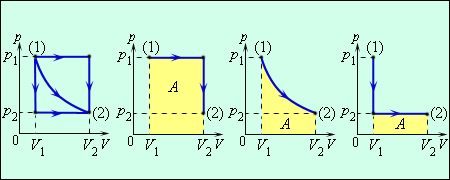 .
.
Опыты Джоуля доказали эквивалентность работы и количества теплоты, т.е. и та и другая величины являются мерой изменения энергии, их можно измерять в одинаковых единицах: 1 кал = 4,1868 Дж ≈ 4,2 Дж. Эта величина наз. механическим эквивалентом теплоты.
Р. Майер, Д. Джоуль, Г. Гельмгольц - закон сохранения энергии для тепловых процессов –
1-й закон термодинамики:
 2020-06-29
2020-06-29 705
705








