5. 3,28 г ацетата натрия было добавлено к 500 мл 0,1 М раствора уксусной кислоты. К полученному раствору было добавлено 1 мл 6 М раствора 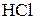 . Вычислить величины рН исходного буферного раствора, а также раствора, полученного в результате добавления кислоты, если
. Вычислить величины рН исходного буферного раствора, а также раствора, полученного в результате добавления кислоты, если 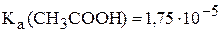 (считать, что при смешении растворов не происходит изменения объёма). (4,66; 4,54)
(считать, что при смешении растворов не происходит изменения объёма). (4,66; 4,54)
6. Какой объём 0,1 М раствора  необходимо добавить к 50 мл M раствора
необходимо добавить к 50 мл M раствора 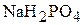 , чтобы полученный раствор имел значение рН 7? Величина
, чтобы полученный раствор имел значение рН 7? Величина  . (61,7 мл)
. (61,7 мл)
14. ГИДРОЛИЗ СОЛЕЙ
Пример 1. Написать уравнения гидролиза следующих солей в ионном и молекулярном виде (основная стадия):  ;
;  ;
;  .
.
Ответ. Арсенаты гидролизованы по аниону, сульфат кобальта – по катиону. Первые стадии гидролиза в ионном и молекулярном виде описываются следующими уравнениями:


 ,
,


 ,
,


 ,
,


 .
.
Соли  гидролизуются особенно, с образованием малорастворимых ильных соединений:
гидролизуются особенно, с образованием малорастворимых ильных соединений:


 .
.
нитрат висмутила
Написание знака равновесия допустимо, хотя и выпадает осадок малорастворимого  , поскольку прибавление кислоты в реакционную смесь ведёт к растворению осадка и смещению равновесия влево.
, поскольку прибавление кислоты в реакционную смесь ведёт к растворению осадка и смещению равновесия влево.
|
|
|
Пример 2. Указать рН (> 7, < 7, = 7) водных растворов следующих солей:  ;
;  ;
;  ;
;  ;
;  .
.
Ответ. Основной причиной отклонения рН растворов средних солей от 7 – гидролиз. В случае кислых солей, способных к диссоциации и гидролизу, рН раствора будет определяться преобладающим процессом. Например, в случае водного раствора  преобладающим процессом будет гидролиз (константы гидролиза в несколько десятков тысяч раз больше константы диссоциации иона
преобладающим процессом будет гидролиз (константы гидролиза в несколько десятков тысяч раз больше константы диссоциации иона  ), поэтому раствор имеет рН > 7:
), поэтому раствор имеет рН > 7:


 ,
,


 .
.
Хлорид Fe(III) и бромид аммония гидролизованы по катиону, поэтому их растворы имеют рН < 7:


 ,
,


 ,
,


 основная
основная


 стадия
стадия
В случае солей, гидролизующихся по катиону и аниону одновременно, рН раствора будет определяться направлением преимущественного гидролиза. Так, в случае формиата аммония



константа гидролиза по катиону имеет порядок  , а по аниону
, а по аниону  . Таким образом, гидролиз по катиону идёт в большей степени, и водный раствор названной соли имеет рН < 7.
. Таким образом, гидролиз по катиону идёт в большей степени, и водный раствор названной соли имеет рН < 7.
рН водного раствора  близок к 7, поскольку данная соль гидролизу не подвергается.
близок к 7, поскольку данная соль гидролизу не подвергается.
Пример 3. Написать уравнения реакций:




Ответ. Первые два процесса отражают взаимодействия в растворах смешиваемых солей, одна из которых гидролизована по катиону, другая – по аниону. Происходит взаимное усиление гидролиза или, иногда говорят, совместный гидролиз. При этом при смешении с растворами карбонатов растворов солей двухзарядных катионов (естественно подвергающихся гидролизу) образуются основные карбонаты, а в случае солей трёхзарядных катионов гидролиз происходит полностью (до конца):
|
|
|
 ,
,
 .
.
Галогенангидриды кислот, например  , подвергаются, как правило, глубокому гидролизу с образованием двух кислот:
, подвергаются, как правило, глубокому гидролизу с образованием двух кислот:
 .
.
Гидролиз солей сурьмы, как и солей  , протекает с образованием малорастворимых ильных соединений:
, протекает с образованием малорастворимых ильных соединений:



хлористый антимонил
Знак равновесия допустим, так как при добавлении соляной кислоты в гидролизованную смесь ведёт к растворению осадка.
Пример 4. Определить рН 0,10 М раствора нитрата металла(II), если константа диссоциации  составляет
составляет  .
.
Ответ. Рассматриваем первую ступень гидролиза:


 ,
,
 .
.
С другой стороны
 .
.
Пренебрежение  в знаменателе дроби оправдано тем, что
в знаменателе дроби оправдано тем, что  .
.
Находим концентрацию ионов водорода и рН раствора:
 ,
,
 .
.
Пример 5. Вычислить рН 0,10 М раствора  , если константы ступенчатой диссоциации угольной кислоты равны соответственно:
, если константы ступенчатой диссоциации угольной кислоты равны соответственно:  ;
;  . При вычислении ограничиться рассмотре-нием только первой ступени гидролиза.
. При вычислении ограничиться рассмотре-нием только первой ступени гидролиза.
Ответ. Уравнение гидролиза  по аниону:
по аниону:


 .
.
Вычисление константы гидролиза:
 .
.
С другой стороны,
 .
.
Пренебрежение  в знаменателе оправдано тем, что
в знаменателе оправдано тем, что  .
.
Находим концентрацию ионов  и рН раствора:
и рН раствора:
 ,
,
 ,
,
 .
.
Пример 6. Вычислить константу гидролиза, степень гидролиза соли и рН 0,10 М раствора формиата аммония, приняв константы диссоциации  и
и  в водном растворе соответственно равными
в водном растворе соответственно равными  и
и  .
.
Ответ. Рассматриваемая соль подвергается гидролизу по катиону и аниону одновременно:


 .
.
Запишем выражение для константы гидролиза и вычислим её значение:

 .
.
Обратим внимание, что
 .
.
С учётом этого преобразуем выражение для константы гидролиза к виду:
 .
.
Отсюда получаем выражение для концентрации ионов водорода, находим 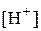 и рН раствора:
и рН раствора:
 ;
;
 .
.
Наконец, ещё раз возвращаемся к выражению для константы гидролиза, принимая степень гидролиза за h, а концентрацию соли в растворе за с моль/л. Поскольку
 и
и  ,
,
то
 .
.
Как видно, степень гидролиза соли, подвергающейся гидролизу по катиону и аниону одновременно, не зависит от концентрации соли в растворе.
Для нашего случая
 .
.
Вариант 1
1. Написать уравнения гидролиза следующих солей в ионном и молекулярном виде (основная стадия):  ;
;  ;
;  ;
;  .
.
2. Указать рН (> 7, < 7, = 7) водных растворов следующих солей:  ;
;  ;
;  ;
;  .
.
3. Написать уравнения реакций:




4. Вычислить по справочным данным константу гидролиза иона аммония и определить рН и степень гидролиза соли в 0,10 М растворе  . (
. ( ; 5,1;
; 5,1;  )
)
5. Проанализировать вопрос о гидролизе солей  ,
,  и
и  в водном растворе, принимая во внимание, что константы ступенчатой диссоциации
в водном растворе, принимая во внимание, что константы ступенчатой диссоциации  составляют:
составляют:  ;
;  ;
;  . Найти рН 0,10 М раствора
. Найти рН 0,10 М раствора  . (
. ( не гидролизуется; 12,6)
не гидролизуется; 12,6)
6. Вычислить рН водного раствора цианида аммония, приняв константы диссоциации  и HCN равными
и HCN равными  и
и  , соответственно. Какова степень гидролиза соли в растворах
, соответственно. Какова степень гидролиза соли в растворах  ? (9,24; 0,491)
? (9,24; 0,491)
Вариант 2
1. Написать уравнения гидролиза следующих солей в ионном и молекулярном виде (основная стадия):  ;
;  ;
;  ;
;  .
.
2. Указать рН (> 7, < 7, = 7) водных растворов следующих солей:  ;
;  ;
;  ;
; 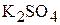 .
.
3. Написать уравнения реакций:




4. рН раствора хлорида аммония составляет 5,0. Найти молярную концентрацию раствора соли, считая, что константа диссоциации  равна
равна  . (0,17 М)
. (0,17 М)
5. Найти рН и степень гидролиза соли в 0,50 М растворе  , принимая во внимание только первую ступень гидролиза. Необходимая в расчёте константа гидролиза вычисляется по справочным данным. (10,5;
, принимая во внимание только первую ступень гидролиза. Необходимая в расчёте константа гидролиза вычисляется по справочным данным. (10,5;  )
)
6. Обычно сульфаты считаются солями, не подвергающимися гидролизу по аниону. Вычислить рН 0,10 М раствора сульфата аммония с учётом и без учёта гидролиза по аниону, приняв константы диссоциации  и
и  равными
равными  и
и  соответственно.
соответственно.
[5,13 (без учёта гидролиза иона  ); 5,63 (с учётом гидролиза иона
); 5,63 (с учётом гидролиза иона  )]
)]
Вариант 3
1. Написать уравнения гидролиза следующих солей в ионном и молекулярном виде (основная стадия): 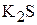 ;
;  ;
;  ;
;  .
.
|
|
|
2. Указать рН (> 7, < 7, = 7) водных растворов следующих солей: 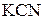 ;
;  ;
;  ;
;  .
.
3. Написать уравнения реакций:




4. рН 0,50 М раствора нитрата аммония составляет 4,76. Вычислить константу и степень гидролиза соли в растворе. ( ;
;  )
)
5. Вычислить константу гидролиза цианидного иона в водном растворе по справочным данным. Вычислить молярную концентрацию раствора цианистого калия, имеющего рН равным 11. ( ; 0,059 М)
; 0,059 М)
6. Вычислить рН водного раствора гидрофосфата аммония и степень гидролиза соли в растворе, приняв константу диссоциации  равной
равной  . Константы ступенчатой диссоциации
. Константы ступенчатой диссоциации  составляют:
составляют:  ;
;  ;
;  . (8,24; 0,0872)
. (8,24; 0,0872)
Вариант 4
1. Написать уравнения гидролиза следующих солей в ионном и молекулярном виде (основная стадия):  ;
;  ;
;  ;
;  .
.
2. Указать рН (> 7, < 7, = 7) водных растворов следующих солей:  ;
;  ;
; 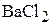 ;
; 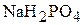 .
.
3. Написать уравнения реакций:




4. рН 0,10 М раствора хлорида аммония равен 5,1. Чему равен рН 1,0 М раствора этой соли? (4,6)
5. Вычислить константу гидролиза формиатного аниона в водном растворе по справочным данным. Вычислить рН 0,5 М раствора формиата калия. ( ; 8,7)
; 8,7)
6. Вычислить рН водного раствора пропионата аммония и степень гидролиза соли в растворе, приняв константы диссоциации  и
и  равными
равными  и
и  соответственно. (7,04; 0,00604)
соответственно. (7,04; 0,00604)
Вариант 5
1. Написать уравнения гидролиза следующих солей в ионном и молекулярном виде (основная стадия):  ;
;  ;
;  ;
;  .
.
2. Указать рН (> 7, < 7, = 7) водных растворов следующих солей:  ;
;  ;
;  ;
;  .
.
3. Написать уравнения реакций:




4. Раствор соли, гидролизованной по катиону, разбавили в 100 раз. Как и на сколько единиц изменился при этом рН раствора?
(Увеличится на 1)
5. Вычислить рН 0,5 М раствора цианида аммония, если константы диссоциации  и
и 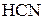 равны соответственно
равны соответственно  и
и  . (9,3)
. (9,3)
6. Вычислить рН водного раствора хлорацетата аммония и стпень гидролиза соли в растворе, приняв константы диссоциации  и
и  равными
равными  и
и  соответственно.
соответственно.
(6,05;  )
)
15. ДИССОЦИАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Пример 1. Написать уравнения диссоциации следующих комплексных соединений по внешней и внутренней сферам:  ;
;  .
.
Ответ. По внешней сфере комплексные соединения диссоциируют в водных растворах по типу сильных (неассоциированных) электролитов, а по внутренней сфере – по типу слабых электролитов:
|
|
|
 ,
,


 ,
,
 ,
,
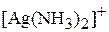

 .
.
 2020-09-24
2020-09-24 258
258








