Формирование новых знаний. Лекционный блок.
План изучения темы:
1.Роль белков в организме, природные источники белков.
2.Состав и строение белков.
3.Функции белков.
4.Физические и химические свойства белков.
5.Синтез белков.
6.Превращения белков в организме
Из органических веществ, входящих в живую клетку, важнейшую роль играют белки. На их долю приходится около 50% массы клетки. Благодаря белкам организм приобрел возможность двигаться, размножаться, расти, усваивать пищу, реагировать на внешние воздействия и т. д.
«Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка», – писал Энгельс в своих трудах.
Содержание белков в различных тканях человека неодинаково. Так, мышцы содержат до 80% белка, селезенка, кровь, легкие – 72%, кожа – 63%, печень – 57%, мозг – 15%, жировая ткань, костная и ткань зубов – 14–28%.
|
|
|
Белки – необходимые компоненты пищевых продуктов, они входят в состав лекарственных препаратов.
Белок – важный компонент пищи человека. Основные источники пищевого белка: мясо, молоко, продукты переработки зерна, хлеб, рыба, овощи. Потребность в белке зависит от возраста, пола, вида деятельности. В организме здорового человека должен быть баланс между количеством поступающих белков и выделяющимися продуктами распада. Для оценки белкового обмена введено понятие белкового баланса. В зрелом возрасте у здорового человека существует азотное равновесие, т.е. количество азота, полученного с белками пищи равно количеству выделяемого азота. В молодом, растущем организме идет накопление белковой массы, поэтому азотный баланс будет положительный, т.е. количество поступающего азота превышает количество выводимого из организма. У людей пожилого возраста, а также при некоторых заболеваниях наблюдается отрицательный азотный баланс. Длительный отрицательный азотный баланс ведет к гибели организма.
Необходимо помнить, что некоторые аминокислоты при тепловой обработке, длительном хранении продуктов могут образовывать неусвояемые организмом соединения, т.е. становиться “недоступными”. Это снижает ценность белка.
Животные и растительные белки усваиваются организмом неодинаково. Если белки молока, молочных продуктов, яиц усваиваются на 96%, мяса и рыбы – на 93–95%, то белки хлеба – на 62–86%, овощей – на 80%, картофеля и некоторых бобовых – на 70%. Однако смесь этих продуктов может быть биологически более полноценной.
На степень усвоения организмом белков оказывает влияние технология получения пищевых продуктов и их кулинарная обработка. При умеренном нагревании пищевых продуктов, особенно растительного происхождения, усвояемость белков несколько возрастает. При интенсивной тепловой обработке усвояемость снижается.
|
|
|
Суточная потребность взрослого человека в белке разного вида 1–1,5 г на 1 кг массы тела, т.е. приблизительно 85–100 г. Доля животных белков должна составлять приблизительно 55% от общего его количества в рационе.
2. Строение белков.
Многие органические соединения, входящие в состав клетки, характеризуются большими размерами молекул. Как называются такие молекулы? (макромолекулы) Они состоят обычно из повторяющихся сходных по строению низкомолекулярных соединений, связанных между собой ковалентными связями. Их строение можно сравнить с бусинками на нити. Как называются эти составные элементы? (Мономеры). Они образуют полимеры. Большинство полимеров построено из одинаковых мономеров. Такие мономеры называются регулярными. Например, если А – мономер, то –А-А-А-…….А- полимер. Полимеры, в которых мономеры различны по строению, называются нерегулярными. Например, -А-В-Р-П-А-……Г-Р-П-А-. Состав определяет их свойства.
Белки – нерегулярные полимеры, мономерами которых являются аминокислоты.
Белки – это сложные высокомолекулярные природные соединения, построенные из -аминокислот. В состав белков входит 20 различных аминокислот, отсюда следует огромное многообразие белков при различных комбинациях аминокислот. Как из 33 букв алфавита мы можем составить бесконечное число слов, так из 20 аминокислот – бесконечное множество белков. В организме человека насчитывается до 100000 белков.
В состав большинства белков входят 300–500 аминокислотных остатков, но есть и более крупные белки, состоящие из 1500 и более аминокислот. Белки различаются и составом аминокислот и числом аминокислотных звеньев, и особенно порядком чередования их в полипептидных цепях. Расчет показывает, что для белка, построенного из 20 различных аминокислот, содержащего в цепи 100 аминокислотных остатков, число возможных вариантов может составить 10130. Многие белки велики и по длине, и по молекулярной массе.
Инсулин –5700
Рибонуклеаза –12700
Альбумин-36000
Гемоглобин-65000
Белки должны быть при такой массе длинными нитями. Но их макромолекулы имеют формулу компактных шаров (глобул) или вытянутых структур (фибрилл).
Белки подразделяют на протеины (простые белки) и протеиды (сложные белки). Число аминокислотных остатков, входящих в молекулы, различно, например: инсулин – 51, миоглобин – 140. Отсюда Mr белка от 10 000 до нескольких миллионов.
Первая гипотеза о строении молекулы белка была предложена в 70-х годах XIX в. Это была уреидная теория строения белка. В 1903 г. Немецкий ученый Э.Г.Фишер предложил пептидную теорию, которая стала ключом к тайне строения белка. Фишер предположил, что белки представляют собой полимеры из остатков аминокислот, соединенных пептидной связью NH–CO. Идея о том, что белки – это полимерные образования, высказывалась еще в 1888 г. Русским ученым А.Я.Данилевским. Эта теория получила подтверждение в последующих работах. Согласно полипептидной теории белки имеют определенную структуру
Многие белки состоят из нескольких полипептидных частиц, которые складываются в единый агрегат. Так, молекула гемоглобина (С738Н1166S2Fe4O208) состоит из четырех субъединиц. Отметим, что Mr белка яйца = 36 000, Mr белка мышц = 1 500 000.
Первичная структура белка – последовательность чередования аминокислотных остатков, осуществляется за счет пептидных (амидных) связей, все связи ковалентные, прочные.
Вторичная структура – форма полипептидной цепи в пространстве. Белковая цепь закручена в спираль, осуществляется за счет множества водородных связей.
|
|
|
Третичная структура – реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль Третичная структура – клубок из полипептидной спирали. (Демонстрация клубка из эластичного шнура).
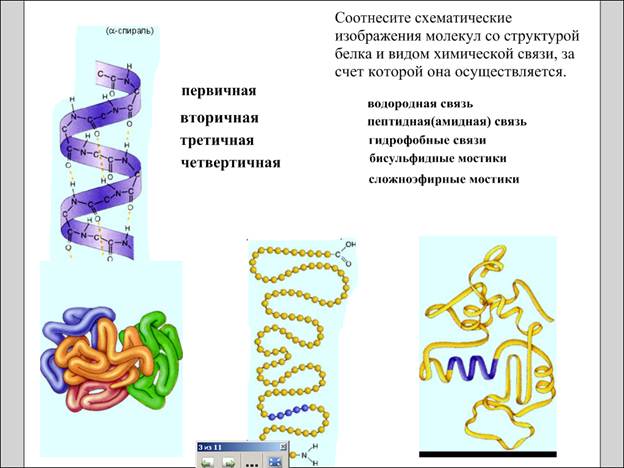
Представить конфигурацию легко, труднее понять, какие силы ее поддерживают. (Водородные связи, дисульфидные мостики –S-S-, сложноэфирная связь между радикалами. Полярные группы COOH и OH взаимодействуют с водой, а неполярные радикалы отталкивают ее, они направлены внутрь глобул. Радикалы взаимодействуют между собой благодаря силам Ван-дер-Ваальса.) (за счет гидрофобных связей), у некоторых белков – S–S-связи (бисульфидные мостики), сложноэфирные мостики..
Четвертичная структура – соединенные друг с другом макромолекулы белков образуют комплекс. Четвертичная структура – структура из нескольких полипептидных цепей
 2014-02-13
2014-02-13 1832
1832








