Из выражения для КПД обратимого цикла Карно
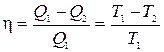
следует, что
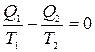 .
.
Если Q 2— количество теплоты, отдаваемое рабочим телом холодильнику, считать отрицательным, то можно записать
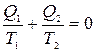 . (1)
. (1)
Величина Q/T называется приведенным количеством теплоты. Из формулы (1) следует, что для цикла Карно алгебраическая сумма приведенных количеств теплоты равна нулю.
Приведенное количество теплоты, сообщаемое телу на бесконечно малом участке процесса, равно dQ/T. Строгий теоретический анализ показывает, что для любого обратимого круговогопроцесса сумма приведенных количеств теплоты равна нулю. Тогда выражение (1) в. общем виде может быть записано как
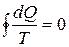 (2)
(2)
Из равенства нулю интеграла, взятого по замкнутому контуру (2), следует, что подынтегральное выражение d Q/T есть полный дифференциал некоторой функции состояния системы (которая не зависит от пути, каким система пришла в это состояние). Таким образом,
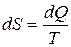
Функция состояния, дифференциалом которой является d Q/T, называется энтропией и обозначается S (введена Клаузиусом).
|
|
|
Из формулы (2) следует, что для обратимых процессов изменение энтропии равно нулю. В термодинамике доказывается, что энтропия системы, совершающей необратимый цикл, возрастает. Вышесказанное справедливо только для замкнутых систем. Это обобщается в виде неравенства Клаузиуса
DS ³0,
т. е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Так как реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии — принцип возрастания энтропии. Этот принцип лежит в основе еще одной формулировки второго начала термодинамики: возможны лишь такие процессы, происходящие в макроскопической системе, которые ведут к увеличению ее энтропии.
Физический смысл энтропии был выяснен Л. Больцманом, предположившим, что энтропия связана с термодинамической вероятностью состояния системы. Термодинамическая вероятность W состояния системы — это число способов, которыми может быть реализовано данное состояние макроскопической системы, или число микросостояний, осуществляющих данное макросостояние. Формула Больцмана имеет следующий вид:
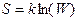
где к — постоянная Больцмана. Следовательно, энтропия может рассматриваться как мера вероятности состояния термодинамической системы. Формула Больцмана дает энтропии следующее смысл: энтропия является мерой неупорядоченности системы..Чем более упорядоченной является система, тем меньшим числом состояний или способов ее можно реализовать, т.е. тем меньше энтропия этой системы.
 2014-02-18
2014-02-18 559
559








