Фтор используют для получения некоторых ценных фторопроизводных углеводородов, обладающих уникальными свойствами, как, например, смазочных веществ, выдерживающих высокую температуру, пластической массы, стойкой к химическим реагентам (тефлон), жидкостей для холодильных машин (фреонов, или хладонов).
Хлор служит для приготовления многочисленных неорганических и органических соединений. Его применяют в производстве соляной кислоты, хлорной извести, гипохлоритов и хлоратов и др. Большое количество хлора используется для отбелки тканей и целлюлозы, идущей на изготовление бумаги. Хлор применяют также для стерилизации питьевой воды и обеззараживания сточных вод. В цветной металлургии его используют для хлорирования руд, которое является одной из стадий получения некоторых металлов.
Особенно большое значение приобрели за последнее время различные хлорорганические продукты. Хлорсодержащие органические растворители — например, дихлорэтан, четыреххлористый углерод — широко применяются для экстракции жиров и обезжиривания металлов. Некоторые хлорорганические продукты служат эффективными средствами борьбы с вредителями сельскохозяй» ствеиных культур. На основе хлорорганических продуктов изготовляют различные пластические массы, синтетические волокна, каучуки, заменители кожи (павинол).
|
|
|
В группах (главных подгруппах) с увеличением зарядов атомных ядер элементов (сверху вниз)
металлические свойства (восстановительные – способность отдавать внешние электроны) усиливаются,
неметаллические (окислительные – способность удерживать внешние электроны и принимать новые) ослабевают, т. к.
oЧисло электронов на внешнем уровне атомов остается одинаковым;
oУвеличивается число энергетических уровней в атоме;
oУвеличивается радиус атомов.
Например, литий – твёрдый металл, а натрий легко режется ножом; натрий энергичнее,
чем литий, реагирует с водой. высшая положительная степень окисления постоянна;
низшая степень окисления не изменяется и равна (8- n), где n – номер группы для (4 – 7 групп). основные свойства соединений усиливаются, кислотные ослабевают.
Токсичность. В воде растворенный хлор присутствует в виде недиссоциированной хлорноватистой кислоты (HOCl) и ионов гипохлорита (ОCl), которые разлагаются с выделением атомарного кислорода и иона хлора. Хлор в виде HOCl более токсичен, чем ион гипохлорита. В нейтральной среде они находятся в равновесии. При рН 6 и ниже происходит сдвиг в сторону увеличения HOCI (до 96%), а в щелочной среде преобладают гипохлорит-ионы. Хлорноватистая кислота также связывается с аммиаком, образуя моно- и дихлорамин. В ее реакции с тиоцианатом выделяется цианистый водород, а в присутствии фенолов образуются хлорфенолы. Поэтому хлорсодержащие соединения действуют на рыб не только самостоятельно, но и в комплексе с хлораминами, цианистой кислотой и хлорфенолами. Свободный хлор и атомарный кислород малостабильны и вызывают острые отравления, а вышеназванные соединения сохраняются длительно и действуют хронически. Токсичность хлора тесно связана с температурой воды. Среднесмертельная концентрация активного хлора при температуре 1,5 — 5° и экспозиции 24 ч составляет для сеголетков карпа 5,6, пестрого толстолобика 3,5 и белого амура 2,9 мг/л (Е. А. Любимов). При температуре 15 — 20° карповые рыбы погибают через 1 — 2 ч
|
|
|
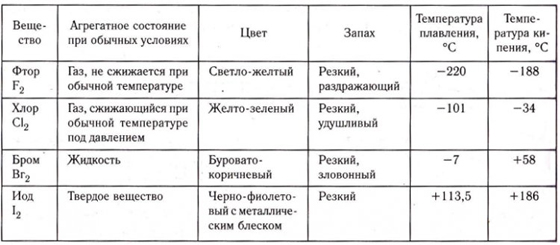
Распространенность в природе. Галогены в природе существуют только в виде соединений с другими элементами. Наиболее распространены хлор и фтор, их содержание составляет 0,19 % и 0,03 % от массы земной коры. Природные соединения галогенов представлены в таблице 16. Все галогены в виде солей содержатся в водах океанов, морей, рек и озер.
 2015-01-30
2015-01-30 818
818








