Моль – это количество вещества, в котором содержится число структурных единиц, равное постоянной Авогадро NA = 6,02 . 1023. Отсюда
а) 6,02 . 1021 СО2 соответствует 0,01 моль, т.к. n(СО2) = 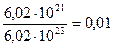 ;
; 
б) 1,20 . 1024 атомов кислорода соответствуют 2 моль атомов кислорода, т.к.
n(O2)= 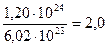 ;
;
в) 2,00 . 1023 молекул воды соответствуют 0,33 моль воды, т. к.
n(H2O)= 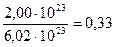 моль.
моль.
Масса 1моль вещества выражается в кг/моль или г/моль. Мольная масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.). Так как относительные молекулярные массы С02, Н2О и относительная атомная масса кислорода соответственно равны 44; 18 и 16 а.е.м., то их мольные массы равны:
а) 44 г/моль; б) 18 г/ моль; в) 16 г/моль.
Эквивалентом вещества называется такое его количество, которое соединяется с 1моль атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Количество вещества эквивалентов nэк связано с количеством вещества n через фактор эквивалентности fэк
n = nэк . fэк.
Фактор эквивалентности равен обратной величине от произведения количества ионов (катионов или анионов) и степени окисления ионов, либо числу передающихся электронов в ходе окислительно-восстановительных реакций. Для простого вещества фактор эквивалентности обратен валентности.
Молярная масса эквивалента Мэк - произведение фактора эквивалентности на молярную массу вещества (г/моль)
Мэк = М . fэк.
ЗАКОН ЭКВИВАЛЕНТОВ - Массы (объемы) реагирующих друг с другом веществ m1 и m2 пропорциональны их молярным массам эквивалентов Мэк(1) и Мэк(2) (эквивалентным объемам).
 2015-01-30
2015-01-30 467
467








