Химические процессы очень похожи на процессы фазовых превращений. В обоих случаях в процессе движения системы к равновесию происходит перераспределение массы вещества (из одной фазы – в другую, или из исходных веществ – в продукты реакции).
По этой причине второй закон термодинамики проявляется аналогично тому, как он действует при фазовых переходах вещества, а именно:
а) при (V, S) = const равновесие определяется как U = U min;
б) при (p, S) = const равновесие определяется как I = I min;
в) при (V, T) = const равновесие определяется как F = F min;
г) при (p, T) = const равновесие определяется как F = Fmin,
где U, I, F,F – внутренняя энергия, энтальпия, изохорно-изотермический потенциал и изобарно-изотермический потенциал соответственно.
Следует отметить, что 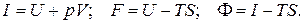
Кроме того,
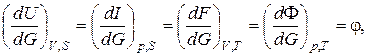
где j – удельный изохорно-изотермический или химический потенциал.
Найдем выражение для химического потенциала идеального газа. Для обратимого процесса
T× ds = di – v× dp,
тогда

отсюда
s = c p× ln T – R × ln p.
Тогда
j = i – T× s = i – Tc p× ln T + RT × ln p = jo + RT × ln p,
|
|
|
где jo – часть химического потенциала, не изменяющаяся при постоянной температуре.
Рассмотрим максимальную работу реакции L max, то есть работу, которую можно получить при химических реакциях в предположении, что все процессы, идущие в ней, обратимы. L max – мера химического сродства, то есть характеризует стремление веществ вступить в химическую реакцию.
Объединенное уравнение 1-го и 2-го законов термодинамики:
T× dS ³ dU + dL + dL *.
Для изохорно-изотермической реакции (dL = 0)
dL * V £ T × dS – dU.
Проинтегрируем это выражение
L * V £ T (S 2 – S 1) – (U 2 – U 1),
но
U – TS = F,
тогда: – L * V max = F 1 – F 2, если процессы обратимы;
– L * V max < F 1 – F 2, если процессы необратимы.
Таким образом, при изохорно-изотермических реакциях максимальная работа равна разности изохорно-изотермических потенциалов.
Для изобарно-изотермической реакции:
dL * p £ TdS – dU – dL.
Проинтегрировав это выражение, получим
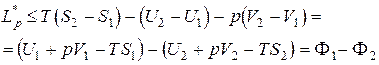
Таким образом: – L * p max = F1 – F2, если процессы обратимы;
– L * p max < F1 – F2, если процессы необратимы.
То есть при изобарно-изотермических реакциях максимальная работа равна разности изобарно-изотермических потенциалов.
В самом общем виде справедливо уравнение Гиббса-Гельмгольца:
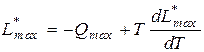
Это уравнение справедливо для обоих рассмотренных случаев, только надо подставлять соответственно QV max и Q p max.
 2015-03-07
2015-03-07 482
482








