Девятый класс
Задача 9-1 (автор Жиров А. И.)
Аммиак традиционно используют в медицине для того, чтобы вывести человека из обморочного состояния.
1. Соль, выделяющая аммиак в газовую фазу, может быть аммонийной солью слабой кислоты:
NH4A (кр.) ⇄ NH3 (газ) + HA(кр., ж.,газ)
Под эти условия лучше всего подходит карбонат (или гидрокарбонат) аммония (продукты реакции не вызывают поражения слизистых оболочек):
(NH4)2CO3 (кр.) ⇄ NH3(газ) + NH4HCO3 (кр.)
NH4HCO3 (кр.) ⇄ NH3 (газ) + CO2 (газ) + H2O (ж.)
2. Карбонат аммония можно получить при нагревании смеси хлорида аммония (нашатырь) и избытка карбоната кальция (мел, известняк) с конденсацией образующихся газообразных продуктов:
CaCO3 + 2NH4Cl = CaCl2 + 2NH3 + CO2 +H2O
2NH3 + CO2 + H2O = (NH4)2CO3
3. В современной медицине и в быту используется водный раствор аммиака («нашатырного спирта»).
4. Смесь сухих солей: хлорида аммония (нашатыря) и карбоната калия (поташа) в мольном соотношении 1: 1:
NH4Cl + K2CO3 = KHCO3 + KCl + NH3
Система оценивания:
1. Состав нюхательной соли 3 балла.
Обоснование 2 балла
Уравнение получение аммиака 1 балл.
|
|
|
2. Получение соли 5 баллов
3. Современный аналог 1 балл
Тривиальное название 1 балл.
4. Состав «нюхательной соли» из двух компонентов 4 балла.
Два тривиальных названия 1·2 – 2 балла
Соотношение 1 балл
Итого 20 баллов
Задача 9-2 (автор Дроздов А. А.)
Фраза о том, что сразу три вещества (E, M, L) реагируют с водой, образуя раствор, дающий белый осадок с хлоридом бария, наводит на мысль, что вещества представляют собой соединения серы, в водном растворе превращающиеся в сульфаты или в серную кислоту. Все это позволяет предположить, что газ Х – хлородоводород, а Y – серная кислота. В таком случае, А – гидросульфат либо сульфат натрия.
Расчет показывает, что массовая доля кислорода в сульфате составляет 32,4 %, а в гидросульфате 19,2 %, что не соответствует приведенному в условии значению. В неизвестном веществе массовая доля кислороде еще выше, чем в средней соли. Остается проверить, не образуется ли кристаллогидрат.
NaHSO4· n H2O
w(O) = (64 + 16 n)/(120 + 18 n) = 0,58. n = 1, таким образом, формула соли NaHSO4·H2O.
NaCl + H2SO4 (70%) ¾¾¾® NaHSO4·H2O + HCl (1)
Y A Х
Плавление этого соединения соответствует растворению его в собственной кристаллизационной воде, а кристаллизация при более высокой температуре – образованию безводного гидросульфата натрия NaHSO4 – вещество B.
NaHSO4×H2O ¾¾¾® NaHSO4 + H2O. (2)
A B
При дальнейшем нагревании B отщепляет воду, превращаясь в пиросульфат Na2S2O7 – вещество С
2NaHSO4 ¾¾¾® Na2S2O7 + H2O, (3)
B C
которое в дальнейшем разлагается, выделяя пары серного ангидрида SO3 и давая сульфат натрия Na2SO4
Na2S2O7 ¾¾¾® Na2SO4 + SO3 (4)
C D E
Взаимодействие D с Y, то есть сульфата натрия с серной кислотой позволяет получить гидрат NaHSO4·H2O, то есть вещество А.
|
|
|
Na2SO4 + H2SO4 + 2H2O ¾¾¾® 2NaHSO4·H2O. (5)
Взаимодействие SO3 с углем приводит к образованию сернистого и углекислого газов, лишь один из которых (газ G – сернистый газ SO2), обесцвечивает раствор перманганата калия.
2SO3 + C = 2SO2 + CO2 (6)
E G
CO2 + Ca(OH)2 = CaCO3¯ + H2O (7)
SO2 + Ca(OH)2 = CaSO3¯ + H2O (8)
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4 (9)
G
Хлор взаимодействует с сернистым газом с образованием хлорида сульфурила SO2Cl2 – хлорангидрида серной кислоты (вещество L).
SO2 + Cl2 = SO2Cl2 (10)
G L
Мы знаем, что соединение М содержит серу, кислород и хлор, причем массовая доля кислорода известна. Оба исходные вещества – типичные окислители, содержащие серу в высшей степени окисления. Это позволяет предположить, что в М сера также +6, а реакция его образования не сопровождается переносом электронов. В то же время содержание кислорода в М должно быть больше, чем в SO2Cl2 (L). В таком случае, попробуем подобрать формулу М, исходя из степеней окисления S(+6), O(–2), Cl(–1).
Простейший из вариантов SO2Cl2 n SO3 имеет формулу S2O5Cl2, которая соответствует взаимодействию реагентов в эквимолярном соотношении. Наше предположение подтверждает расчет массовой доли кислорода.
Взаимодействие вещества (L) с серным ангидридом приводит к образлованию хлорангидрида дисерной кислоты (М).
SO2Cl2 + SO3 = S2O5Cl2 (11)
L E M
SO3 + H2O = H2SO4 (12)
SO2Cl2 + 2H2O = H2SO4 + 2HCl (13)
S2O5Cl2 + 3H2O = 2H2SO4 + 2HCl (14)
H2SO4 + BaCl2 = BaSO4¯ + 2HCl (15)
AgNO3 + HCl = AgCl¯ + HNO3 или 2AgNO3 + H2SO4 = Ag2SO4¯ + 2HNO3 (16)
Вещество М – хлорангидрид дисерной (пиросерной) кислоты. Оно имеет строение:
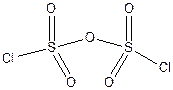
Система оценивания:
1. Формулы соединений Х, Y, A – M 1 балл ´ 11 = 11 баллов;
2. Уравнения реакций (16 реакций) 0,5 балла ´ 16 = 8 баллов;
3. Структурная формула М 1 балл;
Итого 20 баллов.
Задача 9-3 (автор Емельянов В. А.)
1. В реакциях металлов с кислотами, щелочами и водой выделяется водород. Его количество составило 0,84 / 22,4 = 0,0375 моль. Один моль металла вытесняет n /2 молей водорода, где n – степень окисления этого металла в образующемся соединении: М + n H2O = M(OH) n + n /2 H2 (это упрощенная схема). Пусть Mr – атомная масса нашего металла, тогда его количество 0,675/ Мr (моль) и оно должно вытеснить (0,675/ Mr)· n /2 моль Н2, что составило 0,0375 моль. Решая уравнение относительно Mr / n, получаем Mr / n = 0,675/(0,0375·2) = 9. Перебирая n от 1 до 8, получаем следующие результаты:
При n = 1 Mr = 9, M = Be, но он не проявляет степень окисления + 1;
При n = 2 Mr = 18, такого металла нет;
При n = 3 Mr = 27, M = Al и его характерная степень окисления именно + 3;
При n = 4 и выше – таких металлов либо нет, либо это не их степень окисления.
Итак, наш металл – алюминий, который полностью подходит под описание металла А.
2. Эрстед: Al2O3 + 3C + 3Cl2 = 2AlCl3 + 3CO; AlCl3 + 3K(Hg) = 3KCl + Al + Hg.
Девиль: NaAlCl4 + 3Na = 4NaCl + Al.
Растворение алюминия в щелочи: Al + NaOH + 3H2O = Na[Al(OH)4] + 3/2H2.
Холл и Эру независимо друг от друга обнаружили, что тугоплавкий оксид алюминия хорошо растворяется в расплаве относительно легкоплавкого (T пл. около 1000 °С) криолита Na3AlF6. Суть метода, до сих пор использующегося для промышленного получения алюминия, – электролиз раствора Al2O3 в расплаве Na3AlF6. Схема процесса, который на самом деле значительно сложнее, выглядит так: 2Al2O3 = 2Al (катод) + 3O2 (анод).
3. Al + 6HNO3(конц) 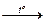 Al(NO3)3 + 3H2O + 3NO2 (можно N2O); (1)
Al(NO3)3 + 3H2O + 3NO2 (можно N2O); (1)
8Al + 15H2SO4(конц)  4Al2(SO4)3 + 12H2O + 3H2S (можно SO2); (2)
4Al2(SO4)3 + 12H2O + 3H2S (можно SO2); (2)
8Al + 30HNO3(разб) = 8Al(NO3)3 + 9H2O + 3NH4NO3 (можно N2O или NO); (3)
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2; (4)
4Al + 3С = Al4С3; (5)
2Al + 3S = Al2S3; (6)
Al2S3 + 6H2O = 2Al(OH)3¯ + 3H2S; (7)
Al4C3 + 12H2O = 4Al(OH)3¯ + 3CH4. (8)
4. а) среди металлов – первое; б) среди всех элементов – третье (после О и Si). Уравнение радиоактивного распада: 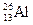 =
= 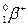 +
+ 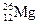 . 2 млн 160 тыс лет – это 2160000/720000 = 3 периода полураспада. За это время содержание изотопа 26Al уменьшится в 23 = 8 раз.
. 2 млн 160 тыс лет – это 2160000/720000 = 3 периода полураспада. За это время содержание изотопа 26Al уменьшится в 23 = 8 раз.
5. Пропускание избытка углекислого газа через образовавшийся раствор приведет к нейтрализации щелочи с образованием гидрокарбоната натрия и вытеснению еще более слабой, чем угольная, и нерастворимой в воде кислоты – гидроксида алюминия: NaOH + СO2 = NaHCO3, Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3¯. Таким образом, в осадке 1 находится гидроксид алюминия, а в растворе после его отделения – гидрокарбонат натрия (вещество Б). Концентрация щелочи составляла 1 моль/л, следовательно, и его концентрация вроде должна быть такой же. Правда, это довольно высокая концентрация и не очевидно, все ли наше вещество осталось в растворе при 0 °С, т. е. хватает ли его растворимости, или часть его оказалась в осадке 1. К тому же в условии задачи сказано, что получен насыщенный раствор Б. Ответ на поставленный вопрос легко дадут результаты прокаливания осадка. В самом деле, нагревание гидроксида алюминия рано или поздно должно было привести к образованию оксида Al2O3, количество которого составляет половину от растворенного алюминия, т. е. 0,5·0,675/27 = 0,0125 моля, а это всего 0,0125·102 = 1,275 г. А у нас даже после прокаливания при 2000 °С осталось 1,833 г. Стало быть, дополнительные 1,833 – 1,275 = 0,558 г в остатке 4 появились из-за присутствия в осадке 1 гидрокарбоната натрия.
|
|
|
Теперь наши сомнения развеялись, и мы можем точно сказать, что белый осадок 1 – это смесь NaHCO3 и Al(OH)3. Гидрокарбонат неустойчив и выше 150 °С разложится: 2NaHCO3 = Na2CO3 + H2O + CO2. Карбонат натрия с оксидом алюминия дает метаалюминат натрия: Na2CO3 + Al2O3 = 2NaAlO2 + CO2. Чтобы не решать систему уравнений, посчитаем количество оксида натрия (свободного, или связанного, все равно) в остатке 4: 0,558/62 = 0,009 моля или 0,018 моля в расчете на натрий. Получается, что в осадке 1 оказалось 0,018 моля NaHCO3. Тогда его концентрация в остаточном растворе составит (0,1·1 – 0,018)/0,1 = 0,82 моль/л.
Итак, в остатке 4 0,675/27 = 0,025 моля атомов алюминия и 0,018 моля атомов натрия, т. е. небольшой избыток Al сверх стехиометрии NaAlO2. В таком случае остаток 4 – это смесь NaAlO2 и Al2O3.
При 600 °С карбонат натрия еще устойчив. Его масса составляла 0,009·106 = 0,954 г, остальные 2,229 ‑ 0,954 = 1,275 г приходятся на соединение алюминия, что точно совпадает с нашим расчетом для его оксида. Таким образом, остаток 3 – это смесь Na2CO3 и Al2O3.
|
|
|
С остатком 2 дело обстоит несколько сложнее. Мы уже договорились, что исходный гидрокарбонат при 250 °С превратится в карбонат, масса которого 0,954 г. Тогда 2,454 – 0,954 = 1,5 г – это соединение алюминия. Его молярная масса в расчете на 1 моль алюминия составит 1,5/0,025 = 60 г/моль, т. е. 60 – 27 = 33 г/моль приходится на что-то еще. Это что-то, безусловно, кислород и водород (больше нечему), причем ровно 2 моля атомов кислорода и 1 моль атомов водорода. Действительно, соединение состава AlO(OH) отвечает требованиям валентности, реально существует (диаспор, бёмит) и образуется при нагревании гидроксида алюминия до 200 °С: Al(OH)3 = AlO(OH) + Н2О. Дальнейшее нагревание (360–575 °С) приводит к его разложению на оксид алюминия и воду: AlO(OH) = Al2O3 + Н2О. Остаток 2 – это смесь Na2CO3 и AlO(OH).
Система оценивания:
1. Определение алюминия 1б, подтверждение расчетом 1б 2 балла;
2. Все реакции (Эрстеда, Девиля и с NaOH) 2б, суть метода 1б 3 балла;
3. Химические свойства (уравнения реакций) 4 балла;
4. Распространенность 1б, распад 1б, содержание 1б 3 балла;
5. Качественный состав 4·1 = 4б, название и концентрация Б 1 8 баллов
Итого 20 баллов
 2015-04-12
2015-04-12 356
356







