Рассчитаем относительную скорость реакции во всех вариантах опыта по формуле 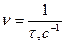 . Данные внесем в таблицу 1.
. Данные внесем в таблицу 1.
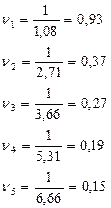
Построим график зависимости скорости реакции от концентрации реагирующих веществ.
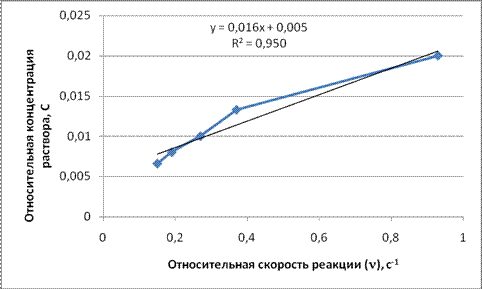
В химической кинетике исходят из того, что реагируют только не частицы, которые сталкиваются. В любой системе число столкновений пропорционально числу имеющихся частиц, следовательно, скорость химической реакции должна быть пропорциональна произведению концентраций реагирующих веществ и с увеличением концентрации веществ должна увеличиваться. Что подтверждается ЗДМ: 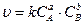
Вывод
В соответствии с ЗДМ и по результатом опыта установили, что изменение скорости химической реакции прямо-пропорционально изменению концентрации реагирующих веществ. Т.е. с увеличением/уменьшением концентрации увеличивается/уменьшается скорость химической реакции.
2. Название опыта: Зависимость скорости реакции от температуры
2.1. Ход и данные опыта
Условие проведения опыта: Воспользуемся реакцией окисления щавелевой кислоты (H2C2O4) перманганатом калия (KMnO4) в присутствии серной кислоты. Уравнение реакции имеет вид
|
|
|
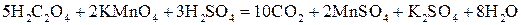
или в ионной форме
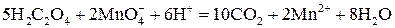 .
.
В кислой среде ион 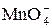 восстанавливается в ион
восстанавливается в ион 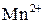 , в результате цвет раствора изменяется: от красно-фиолетового цвета (цвет иона
, в результате цвет раствора изменяется: от красно-фиолетового цвета (цвет иона 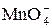 ) до бледно-розового (цвет иона
) до бледно-розового (цвет иона 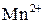 при большой концентрации) или бесцветного (при малой концентрации). Реакция проводится при постоянной концентрации реагирующих веществ и переменной температуре (табл.2).
при большой концентрации) или бесцветного (при малой концентрации). Реакция проводится при постоянной концентрации реагирующих веществ и переменной температуре (табл.2).
Порядок выполнения опыта: Взяли 8 пробирок и поместили в 4 из них по 20 капель 0,1 н раствора H2C2O4. В остальные 4 пробирки внесите в каждую 20 капель KMnO4 и 20 капель концентрированной серной кислоты H2SO4 (строго соблюдали указанную последовательность сливания растворов). Охладили полученные смеси на воздухе (или под струей холодной воды) до комнатной температуры.
Поместили пробирку с H2C2O4 и пробирку со смесью KMnO4 и H2SO4 в отверстие крышки, которой закрыт химический стакан, заполненный на 2/3 объема подогретой до 30 ºC водой. Контроль температуры осуществляйте
с помощью спиртового термометра (пробирки и термометр не должны касаться дна стакана). Выдержали пробирки с растворами в течение 1,5 –2 мин, затем перелили содержимое пробирки с подкисленным перманганатом калия в пробирку со щавелевой кислотой, не вынимая последнюю из стакана. Отметили время по секундомеру с момента смешения растворов до полного их обесцвечивания и данные занесли в табл.2.
| Таблица 2 | |||
| Номер опыта | Температура t, °C | Время от начала реакции до конца, 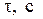
| Относительная скорость реакции 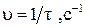
|
| 0,04 | |||
| 11,1 | 0,09 | ||
| 5,3 | 0,19 | ||
| 2,5 | 0,4 |
|
|
|
 2015-05-10
2015-05-10 344
344








